Bone Res:梁超/肖国芝/吕爱平合作揭示了HDAC3-FOXK1-干扰素轴改善类风湿性关节炎的作用机理
时间:2024-07-30 14:01:30 热度:37.1℃ 作者:网络
类风湿性关节炎(RA)是一种自身免疫性疾病。早期研究认为肠道菌群是环境获得的,与RA易感性有关。然而,越来越多的证据表明,遗传因素也会影响肠道菌群。已知一些近交系实验室小鼠品系对胶原诱导性关节炎(CIA)高度敏感,而其他品系对CIA具有抗性。
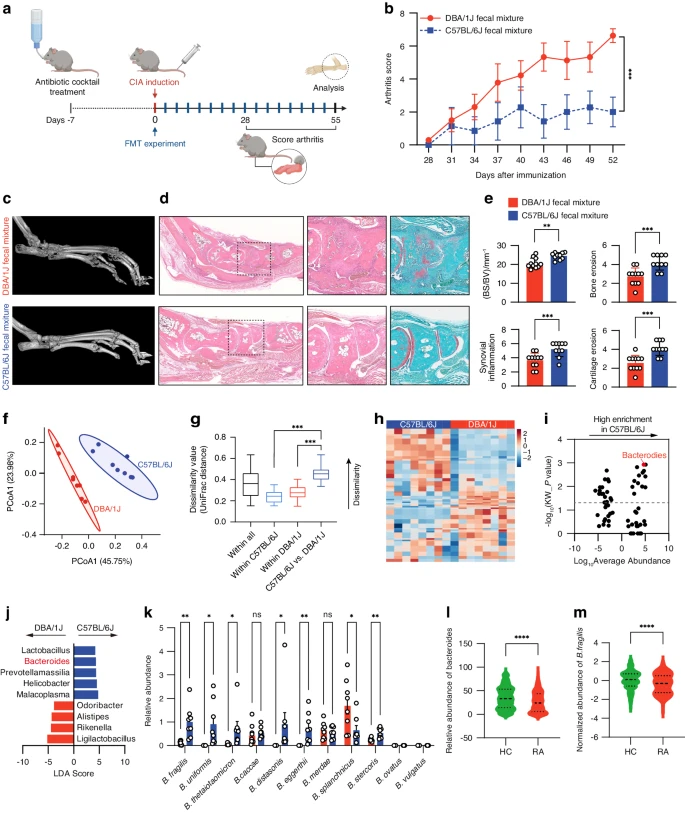
2024年5月23日,南方科技大学梁超、肖国芝和香港浸会大学吕爱平共同通讯在Bone Research 在线发表题为“Gut microbial metabolite targets HDAC3-FOXK1-interferon axis in fibroblast-like synoviocytes to ameliorate rheumatoid arthritis”的研究论文,该研究表明,将CIA抗性的C57BL/6J小鼠的粪便菌群移植到CIA易感的DBA/1J小鼠中,可使DBA/1J小鼠产生CIA抗性。
C57BL/6J小鼠和健康人类个体比DBA/1J小鼠和RA患者富含脆弱拟杆菌。移植脆弱拟杆菌可预防DBA/1J小鼠患上CIA。作者发现脆弱拟杆菌主要产生丙酸,C57BL/6J小鼠和健康人类个体的丙酸水平较高。类风湿性关节炎中的成纤维细胞样滑膜细胞(FLS)被激活,发生肿瘤样转化。丙酸盐破坏HDAC3-FOXK1相互作用,从而增加FOXK1的乙酰化,导致FOXK1稳定性降低、干扰素信号传导受阻和RA-FLS失活。作者用丙酸盐治疗CIA小鼠,结果显示丙酸盐可减轻CIA。此外,丙酸盐与抗TNF依那西普的组合可协同缓解CIA。这些结果表明脆弱拟杆菌或丙酸盐可能是当前疗法的替代或补充方法。

类风湿关节炎(RA)是一种以炎症、滑膜增生和骨与软骨破坏为特征的全身性慢性自身免疫性疾病。超过0.5%–1.0%的成年人口患有RA,女性和老年人的发病率更高。尽管确切的病因尚不明确,但已确定遗传和环境因素共同会增加患上RA的风险。在过去的二十年里,免疫抑制的疾病改良抗风湿药(DMARDs)已经成为RA的治疗标准,包括传统的合成DMARDs(例如甲氨蝶呤、来氟米特、柳氮磺吡啶和羟氯喹)、针对促炎介质(例如TNFα和IL-6)的生物DMARDs以及靶向合成DMARDs(例如JAK抑制剂)。然而,这些药物的疗效不佳导致其在RA患者中的保留率相对较低,因此需要探索新的治疗途径。
从遗传学角度来看,RA是一种多基因疾病,遗传率估计约为65%。迄今为止,全基因组关联研究已鉴定出一百多个显著相关位点和数千个小效应因果变异,这些变异导致不同种族和民族人群中RA易感性,其中至少30%位于主要组织相容性复合体(MHC)基因内,这些基因参与自我和非自我的免疫识别。这些基因位点约占RA中观察到的表型变异的15%。然而,RA易感性仍然具有大量尚未完全了解的遗传成分。具有不同遗传框架的种族和民族多样化的人类群体的RA发病率各不相同。
年龄调整后的RA患病率在北美(0.38%)、西欧(0.35%)和加勒比地区(0.34%)高于大洋洲(0.14%)和撒哈拉以南非洲西部(0.13%)。亚洲各地区的RA患病率估计各不相同,南亚报告0.32%,中亚0.21%,东亚0.19%,东南亚最低,为0.10%。目前,多组学数据、高密度基因分型和生物信息学的进步使研究人员能够利用与RA相关的风险变异来精确定位在疾病功能失调的免疫反应和临床表现中起关键作用的细胞类型和生物途径。然而,许多已知的遗传变异远不能用作治疗靶点,因为它们主要位于非编码元素中,由于潜在风险,这些元素不易被操纵。
近几年来,肠道菌群因其与RA的关系而备受关注。肠道菌群失衡,即菌群失调,被认为是RA发展的重要因素,因为它会影响宿主免疫系统的调节。早期研究认为,肠道菌群是通过环境获得的,主要受饮食、季节、吸烟和感染等外在因素的影响。然而,越来越多的证据表明,遗传变异也会显著影响肠道菌群的组成,进而影响疾病易感性,表明肠道菌群和人类基因组在宿主免疫调节中相互影响。值得注意的是,一项大规模人群队列研究建立了人类宿主和肠道菌群之间的直接基因组间关联,并揭示了由宿主遗传背景决定的特定营养成分可以选择性地塑造携带特定基因组片段的肠道微生物菌株的组成。
遗传变异在不同种族和民族的人类群体中占肠道菌群变异的很大一部分,有些分类群甚至达到40%。因此,作者提出这样的假设:由遗传因素塑造的肠道菌群可能在疾病发作之前预先确定对RA的易感性,而遗传抗性RA群体与遗传易感群体可能是识别有益肠道菌群和开发微生物群导向RA疗法的天然来源。任何两个不同种族的人类群体之间由遗传学决定的肠道菌群很难通过公正的方法确定,因为种族多样化的人类群体不可避免地会受到外部因素的高度多变性的影响,这些因素掩盖了遗传变异对肠道菌群的影响。
供体C57BL/6J小鼠与受体DBA/1J小鼠粪便菌群移植及肠道菌群组成差异(图源自Bone Research )
不同小鼠品系具有不同的遗传背景,与人类的种族和民族相似。小鼠胶原诱导性关节炎(CIA)表现出与人类RA相似的免疫学和病理学特征,是研究影响RA易感性的因素和评估治疗干预措施的最佳模型。众所周知,一些近交系实验室小鼠(例如DBA/1J和B10.RIII)对CIA高度敏感,而其他小鼠(例如C57BL/6J、129/Sv和BALB/c)对CIA具有抗性。与遗传学在人类RA中的作用类似,传统理论认为遗传变异,尤其是MHC基因,决定了不同小鼠品系对CIA的易感性。
尽管如此,最新研究表明,即使在同一环境中饲养,遗传不同的小鼠品系也具有不同的肠道菌群组成,支持上述观点,即遗传塑造了肠道微生物群。鉴于不同小鼠品系可以以相同的方式保存和处理的优势,作者假设利用CIA易感小鼠品系与CIA抗性小鼠品系可以为发现抗关节炎微生物和开发以微生物群为导向的RA治疗方案提供另一种选择。
在本研究中,作者利用CIA抗性的C57BL/6J小鼠品系和CIA易感的DBA/1J小鼠品系来探索肠道微生物群与关节炎易感性之间的关系。将C57BL/6J小鼠的粪便微生物群移植到DBA/1J小鼠中可使DBA/1J小鼠对CIA产生抗性,这促使作者探索C57BL/6J小鼠中抗关节炎的肠道微生物。通过16S核糖体RNA(rRNA)基因测序分析,作者发现C57BL/6J小鼠中脆弱拟杆菌的丰度较高,而移植脆弱拟杆菌可预防DBA/1J小鼠的CIA。靶向和非靶向代谢组学表明,脆弱拟杆菌衍生的丙酸与抗关节炎有关。作者还发现,健康个体的脆弱拟杆菌丰度和丙酸水平高于RA患者。丙酸属于短链脂肪酸(SCFA)类,是一种由共生菌发酵膳食纤维而产生的代谢物。丙酸因其在调节自身免疫性疾病中的免疫细胞功能的作用而得到认可。
然而,SCFA对关节结构细胞的影响仍然知之甚少。成纤维细胞样滑膜细胞(FLS)是重要的结构细胞,存在于关节滑膜的内层和内层下层。它们对于维持关节的稳态至关重要,在关节中它们产生营养血浆和含有润滑分子(如透明质酸)的细胞外基质。在RA中,FLS被激活,发生表型转化为肿瘤样细胞,并产生大量炎症介质,导致滑膜血管翳生长并侵入邻近的软骨和骨骼。作者研究了丙酸盐对RA-FLS的影响,并证明丙酸盐在体外抑制了RA-FLS的病理表型。此外,作者进行了体内研究,并表明丙酸盐单一疗法或丙酸盐与抗TNFDMARD的组合对关节炎取得了理想的治疗效果。
为了明确丙酸的作用机制,作者进行了转录组学和蛋白质组学研究,发现丙酸主要阻断了RA-FLS中的干扰素途径。在用丙酸治疗的RA-FLS中的差异表达蛋白中,ForkheadBoxK1(FOXK1)因其是干扰素途径上游的转录因子而受到关注。在RA-FLS中,丙酸使FOXK1在蛋白质水平上下调,但在mRNA水平上没有下调。到目前为止,大多数与FOXK1相关的研究都强调其在代谢调节中的关键作用,例如葡萄糖和脂质代谢。FOXK1在RA-FLS中的作用尚不清楚。
作者发现FOXK1的基因敲低抑制了RA-FLS的干扰素信号传导和病理转化,这表明FOXK1是RA-FLS中的潜在靶点。为了解释丙酸如何调节FOXK1-干扰素通路,作者检查了组蛋白去乙酰化酶(HDAC)的活性,因为丙酸已被证明是HDAC的抑制剂,尤其是HDAC3。HDAC是重要的表观遗传调节剂。它们作为酶发挥作用,催化乙酰基从许多蛋白质上的赖氨酸残基上分离,从而影响翻译后水平的蛋白质稳定性。作者发现FOXK1是RA-FLS中HDAC3的另一种底物,HDAC3和FOXK1之间的相互作用是保护FOXK1免受溶酶体系统介导的降解所必需的。丙酸破坏了HDAC3-FOXK1相互作用,增加了FOXK1的乙酰化,导致FOXK1稳定性降低、干扰素信号传导受阻和RA-FLS失活。
这项研究确立了CIA小鼠和RA患者肠道菌群与FLS之间的联系。脆弱拟杆菌通过产生丙酸对RA-FLS发挥功能性作用,丙酸靶向HDAC3-FOXK1-干扰素轴,抑制RA-FLS的肿瘤样转化。脆弱拟杆菌导向疗法或丙酸可作为目前DMARD的替代或补充疗法,用于治疗RA。
参考消息:
https://www.nature.com/articles/s41413-024-00336-6


