苏州大学李桢、王婷婷团队《ACS Nano》:通过抑制CD73免疫检查点促进T细胞浸润和活性以增强胶质母细胞瘤免疫治疗
时间:2024-08-19 15:00:32 热度:37.1℃ 作者:网络
目前可用的免疫检查点疗法对多形性胶质母细胞瘤(GBM)的治疗效果令人失望,因此探索更好的免疫检查点将和开发创新的靶向策略非常重要。肿瘤中发现的代谢免疫检查点外-5-核苷酸酶(CD73)由于细胞外腺苷(ADO)的失调而会导致肿瘤的免疫逃避,因为ADO显著抑制抗肿瘤T细胞的功能并增加免疫抑制细胞的活性。
在此,苏州大学李桢教授和王婷婷等人通过使用多功能Au@Cu2–xSe纳米粒子(ACS NP)来显著抑制CD73的表达,以减少ADO的产生。ACS NP可以通过其Fenton样反应缓解肿瘤缺氧,从而减弱ADO驱动的免疫抑制,增强抗肿瘤T细胞浸润和GBM活性,从而降低CD73的表达。ACS NP释放的铜离子(Cu2+)可以与二硫化物螯合,形成细胞毒性双(N,N-二乙基二硫代氨基甲酸酯)-铜络合物(CuET),可以与放射治疗结合,招募更多的抗肿瘤T淋巴细胞浸润到肿瘤部位。基于抑制CD73促进抗肿瘤T细胞的浸润和活性,可以实现增强GBM免疫治疗效果的级联反应。肿瘤内CD8+T和CD4+T细胞以及脾脏中记忆性T细胞的显著增加有效地将肿瘤大小减小了92%,这证明了代谢免疫检查点CD73抑制与放化疗相结合的免疫疗法具有优异的疗效。这项工作表明,调节CD73介导的肿瘤免疫抑制是改善GBM免疫治疗结果的重要策略。相关工作以“Boost Infiltration and Activity of T Cells via Inhibiting Ecto-5′-nucleotidase (CD73) Immune Checkpoint to Enhance Glioblastoma Immunotherapy”为题发表在ACS Nano。

【文章要点】
除了GBM中CD73的高表达引发的免疫抑制外,释放较少的肿瘤相关抗原不能将足够的抗肿瘤T细胞募集到肿瘤部位。如前所述,CD73的上调在放化疗耐药性中起着关键作用,导致放化疗期间有效激活免疫系统的肿瘤相关抗原减少。用于抑制CD73的抗体和小分子在缓解免疫抑制期间不能促进肿瘤相关抗原的释放。因此,联合施用靶向CD73代谢免疫检查点的药物并激活免疫反应以将抗肿瘤T细胞募集到肿瘤中可能是GBM免疫治疗的有效策略。为此,作者报告了通过联合使用多功能核壳ACS NP、二硫化物(DSF)和放射治疗来抑制CD73表达和促进抗肿瘤T细胞募集到肿瘤中,从而显著增强GBM免疫疗法(图1)。
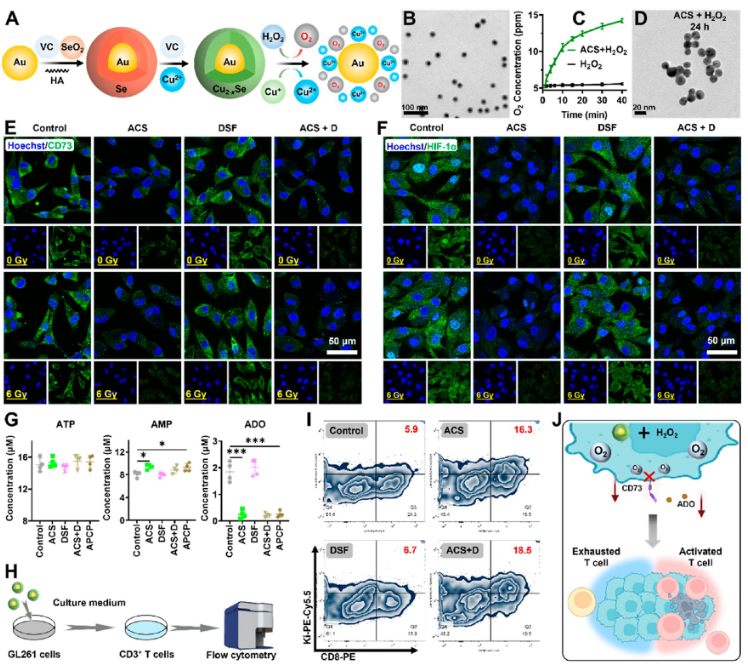
图1 ACS NPs的制备
在聚焦超声的帮助下,ACS NP被精确地递送到肿瘤部位,有效抑制CD73的表达,削弱ADO驱动的免疫抑制,最终增强抗肿瘤T细胞的浸润和活性。释放的铜离子(Cu2+)还可以与口服DSF协同作用,产生细胞毒性双(N,N-二乙基二硫代氨基甲酸酯)-铜络合物(CuET),从而与放射治疗结合,增强抗肿瘤T细胞向肿瘤的募集,最终提高治疗效果(图2)。这项研究表明,通过先进的纳米粒子同时靶向代谢免疫检查点CD73并将更多的抗肿瘤T细胞招募到肿瘤中,在促进肿瘤免疫治疗方面具有巨大的潜力。。
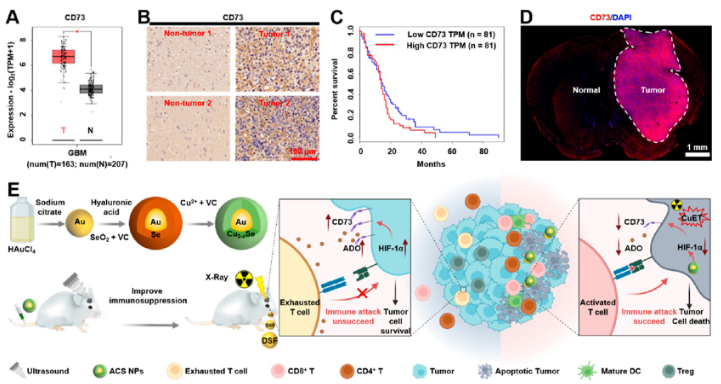
图2 CD73在GBM病人中的表达以及ACS NP、二硫化物(DSF)和放射治疗的联合治疗模式
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c04553


