首例:接种新冠疫苗后,注射Xeomin肉毒发生过敏
时间:2024-08-23 16:02:00 热度:37.1℃ 作者:网络
Hey guys,A型肉毒毒素(BTX-A)注射是治疗面部除皱最常用的治疗方法,因为它的有效性和安全性,通常由手动注射技术产生的不良反应最小。常见的不良反应包括血肿的形成、应用区域周围的轻度局部疼痛,以及由于肉毒毒素向提上睑肌扩散而导致的上睑下垂。
文献仅报告了10例对肉毒毒素美容注射的超敏反应,表现为中度至重度症状,甚至有一例因过敏反应导致的致命病例(表1)。迄今为止,还没有关于使用不含络合蛋白的肉毒毒素A(incoBTX-A)的超敏反应的报道。鉴于与免疫系统激活和免疫介导炎症反应发展相关的病例数量不断增加,新冠的出现和疫苗接种的出现已成为重要的研究课题。本研究介绍了迄今为止最广泛的关于新冠肺炎疫苗接种后对肉毒毒素的超敏反应的病例系列,以及对inco肉毒毒素的超敏初始病例。
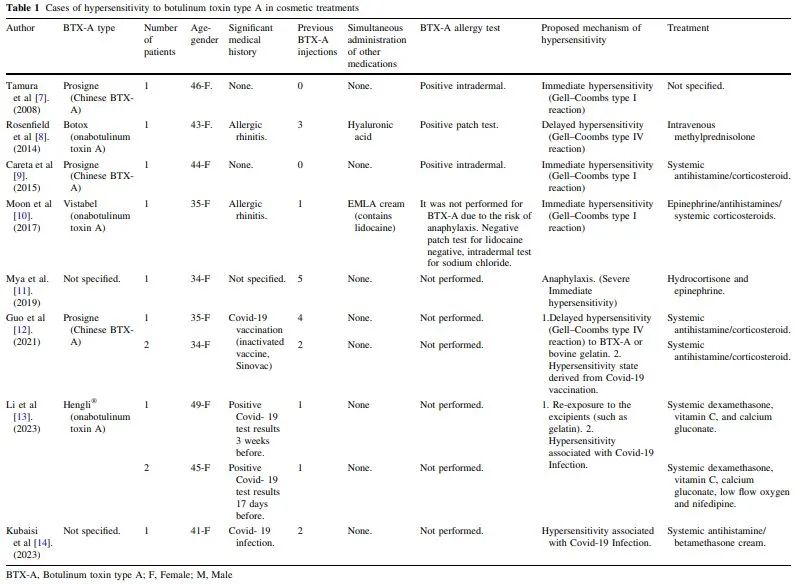
表1
方法
进行了一个回顾性多中心病例系列,涉及12名在接种mRNA新冠肺炎疫苗后出现肉毒毒素超敏的患者。本研究遵循《赫尔辛基宣言》的原则,并获得了患者的书面知情同意书,以发布和使用临床照片。此外,还进行了文献综述,以确定对肉毒毒素超敏的病例,以及新冠肺炎疫苗接种后的过敏反应。
结果
共纳入12例患者(表2)。年龄范围在29至45岁之间。大多数患者是女性(10/12;83.3%)。注射点分布在面部的上三分之一,包括眉间、前额和鱼尾纹。10名患者(83.3%)接受了inco肉毒毒素(肉毒毒素 150 kDa)治疗:病例1和4的Bocouture(Merz Pharma,西班牙S.L.)和病例2、3、5-10的Xeomin(Merz制药有限公司,德国法兰克福);其制剂包括用1.25mL 0.9%氯化钠稀释的50单位容量的inco肉毒毒素小瓶。其余两名患者(16.7%,病例11和12)注射了ona肉毒毒素(Allergan Pharmaceuticals,爱尔兰),该毒素是用50单位小瓶的ona肉毒毒素稀释在1毫升0.9%氯化钠中制备的。
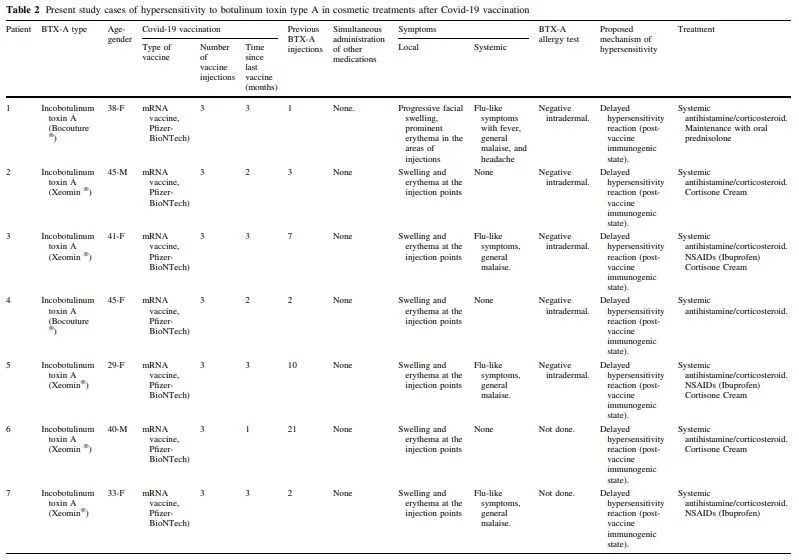
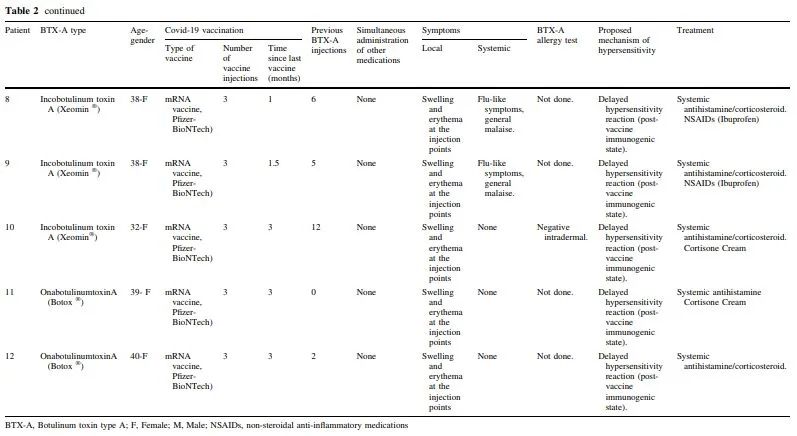
表2
注射是在没有事先应用麻醉的情况下进行的,在任何情况下,注射过程中都没有疼痛或瘙痒的报告。所有患者之前都接受过相同类型的肉毒毒素注射和面部美容手术,没有任何不良反应的证据。他们都没有既往超敏反应史,并且都否认在注射肉毒毒素之前和期间有任何受伤、用药、创伤、昆虫叮咬或接触新环境因素的病史。所有患者在最后一次肉毒毒素注射前1至7个月接种了新冠肺炎疫苗(Comirnaty 30 lg,mRNA疫苗,Pfizer-BioNTech)。在美容疗程注射后的平均24小时内,所有患者都出现了渐进性面部肿胀和红斑,在注射周围区域更为明显(图1A、B)。
6名患者(50%)出现流感样症状,包括发烧和全身不适。未报告吞咽困难或呼吸窘迫。所有患者的全身治疗包括皮质类固醇和抗组胺药。症状恢复的平均时间为5天(范围为3-7天)。为有局部症状的患者添加了可的松乳膏,在一些中度病例中使用了非甾体抗炎药,导致全身症状逐渐改善。一名患者服用口服泼尼松龙进行维持治疗,直至面部水肿有效减轻;7天后实现了完全恢复(图1C)。
由于新冠肺炎疫情封锁,当身体咨询不可行时,患者提供了这些照片。值得注意的是,肉毒毒素的应用在任何患者中都没有导致任何化学去神经或连续肌肉阻滞效应;因此,其作用机制完全失效。
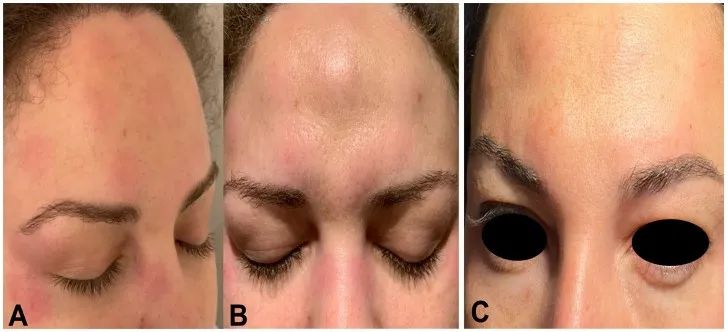
图1
所有患者使用的产品批次不同。事件发生一个月后,对6名患者(50%)进行了肉毒毒素皮内过敏试验。在五个病例中,这是使用相同的inco肉毒毒素制剂进行的。在一名患者(病例1)中,对三种商业肉毒毒素制剂(ona肉毒毒素、inco肉毒毒素和Abo肉毒毒素)进行了过敏皮肤试验。在测试后30分钟、24小时和72小时进行读数。所有病例的结果均为阴性。根据现行法律规定,这些不良反应已及时报告给主管当局和实验室。一年后,在没有进一步接种疫苗的情况下,决定对所有患者恢复肉毒毒素注射(激发试验)的美容治疗。它们都显示出成功的肌肉阻滞效果,没有新的超敏反应或其他并发症。
讨论
据作者所知,本研究介绍了对肉毒毒素超敏反应的最严重病例系列。值得注意的是,它包括第一例报告的inco肉毒毒素病例和第五例和第六例ona病例。此外,它代表了mRNA新冠肺炎疫苗接种后与肉毒毒素超敏反应相关的最高病例数。在目前已知的对医美用途肉毒毒素过敏的病例中,有三例与新冠肺炎感染有关,只有两例与新疫疫苗有关。有5例报告的与使用肉毒毒素相关的超敏反应病例,与新冠肺炎感染和疫苗无关(表1)。所有患者均为女性,其中大多数患者在注射部位周围出现水肿和红斑症状,对全身皮质类固醇和抗组胺药的治疗反应充分。急性病例中已描述了由IgE抗体介导的即时超敏反应(IHR)(Gell-Coombs I型反应)的机制,亚急性病例中描述了由细胞介导的迟发型超敏反应。两例病例与中国肉毒毒素的使用有关(Prosigne,兰州生物制品研究所,中国)。与其他含有人血清白蛋白的肉毒毒素制剂不同,这种制剂含有明胶(一种赋形剂),以防止肉毒毒素粘附在小瓶或注射器壁上。有人提出,动物源性蛋白质可能具有潜在的致敏性,诱导IHR。一例使用化妆品肉毒毒素出现全身过敏反应的病例与注射透明质酸同时给药。症状包括亚急性全身瘙痒和注射部位(前额和眉间)明显红斑。肉毒毒素斑贴试验证实了DHR的诊断。由于严重的IHR和过敏反应,只有一例已知的致命病例与用于化妆品目的的肉毒毒素注射有关。
inco肉毒毒素作为一种不含复合蛋白和/或动物来源的产品的主要应用,以及在接种新冠肺炎疫苗之前几次没有不良影响的历史,使作者能够考虑与疫苗接种相关的新型炎症免疫介导反应的发展。由于DHR不严重,皮肤试验呈阴性,1年后,在不接种后续疫苗的情况下,经患者和医生双方同意,所有患者都恢复了肉毒毒素注射。激发试验中没有记录到新的超敏反应。因此,所有DHR在作者的患者中都是暂时的,这加强了DHR与免疫相关的假设;因此肉毒毒素的后续和单次使用是安全的,没有新冠肺炎疫苗的伴随免疫原性效应。疫苗接种史增加了免疫介导反应的机会,这解释了只有在接种新冠肺炎疫苗后注射肉毒毒素才会出现的系统性临床表现,并且发生在这些已知患者中,这些患者之前对该产品敏感,之前没有不良反应报告。
作者的患者在接种新冠肺炎疫苗后,共有14例与肉毒毒素超敏反应相关的病例,是第一批与mRNA疫苗相关的病例(Comirnaty 30 lg,Pfizer-BioNTech)。之前报道的仅有两例已知病例是用灭活疫苗(Vero Cell,科兴生命科学有限公司)描述的。Inco肉毒毒素是一种肉毒毒素(150 kDa),商品名为Xeomin/Bocuture,是唯一不含络合蛋白的产品,这大大降低了产生中和性抗毒素抗体的风险。
通过皮内试验,作者的六名患者排除了对每种制剂成分的过敏。尽管新冠肺炎疫苗接种可能与免疫原性反应有关,这些反应可能会干扰肉毒毒素的有效性,并可能导致DHR引起的不良反应,但对新冠肺炎并发症的保护益处超过了不常报告的风险。因此,不应气馁。郭等人建议在接种新冠肺炎疫苗后至少2-3个月进行肉毒毒素注射。然而,作者的一名患者在接种疫苗7个月后出现DHR,这突显了认识免疫史的临床重要性,因为有可能促进晚期免疫原性炎症反应。作者发现,1年后,通过连续注射肉毒毒素重新开始治疗对所有患者都是安全的。
临床医生和患者都必须意识到这种潜在的关系,以采取预防措施,识别不良反应,准确诊断肉毒毒素注射液的过敏和/或免疫介导反应,并指导靶向治疗,以获得最佳临床效果。作者的研究有一些局限性,包括只有12名患者的相对较小的样本量。然而,这是迄今为止最大的病例汇编,超过了新冠肺炎大流行前报告的病例数,并为这一现象提供了有价值的见解。
参考文献
1. Padilla-Pantoja FD, Fakih-Gomez N, Muñoz-Gonzalez C, Prazeres S, Galindo-Ferreiro A. Temporary Delayed Hypersensitivity Reaction to Botulinum Toxin-A After COVID-19 Vaccination: A Case Series. Aesthetic Plast Surg. 2024 Jul 24. doi: 10.1007/s00266-024-04274-w. Epub ahead of print. PMID: 39046483.


