Cell:压力过大,竟然能通过扰乱肠道菌群、最终削弱人体免疫力;Nature:可由此找到这些疾病的治疗策略
时间:2024-08-23 22:01:31 热度:37.1℃ 作者:网络
摘要:
-
你敢相信吗?所谓的我们自己的身体,并不仅仅属于人类自己、也同样属于生存于身体的上万亿个微生物;这些微生物总重量约达1公斤左右,并在帮助人体消化、合成维生素、免疫调节中起到重要作用。
-
微生物能调节人体功能,那么人体会主动调节微生物吗?
-
2024年8月1日发表于Cell的一项研究给出了答案:大脑能够主动调节肠道微生物群【1】。
-
在慢性压力下,即使布氏腺体未被移除,小鼠的乳杆菌属细菌水平也会下降,炎性水平上升;益生菌和粘蛋白可恢复缺乏布氏腺动物的免疫功能并促进其生存。
-
这项研究如此重要而极具临床应用价值,所以立即被Nature杂志新闻版面解读并发布在Nature简报【2】。
近年来,越来越多的研究表明,心理压力与人体免疫系统之间存在密切的联系。特别是,肠道微生物群的紊乱被认为是心理压力导致免疫能力下降的一个重要因素。肠道微生物群,甚至被称为人体的“第二大脑”,在调节宿主的免疫反应、代谢过程以及情绪行为等方面发挥着重要作用。然而,心理压力如何具体影响肠道微生物群,进而影响宿主的健康,这一机制尚不完全清楚。
已有研究表明,在压力状态下,大脑会释放激素,这些激素可能触发肠道疾病,如炎症性肠病。同时,肠道中的某些细菌能够释放化学物质,影响大脑和行为。但是,大脑与肠道之间的神经通讯途径,尤其是它们如何相互作用以影响免疫系统,这一领域的研究相对较少。
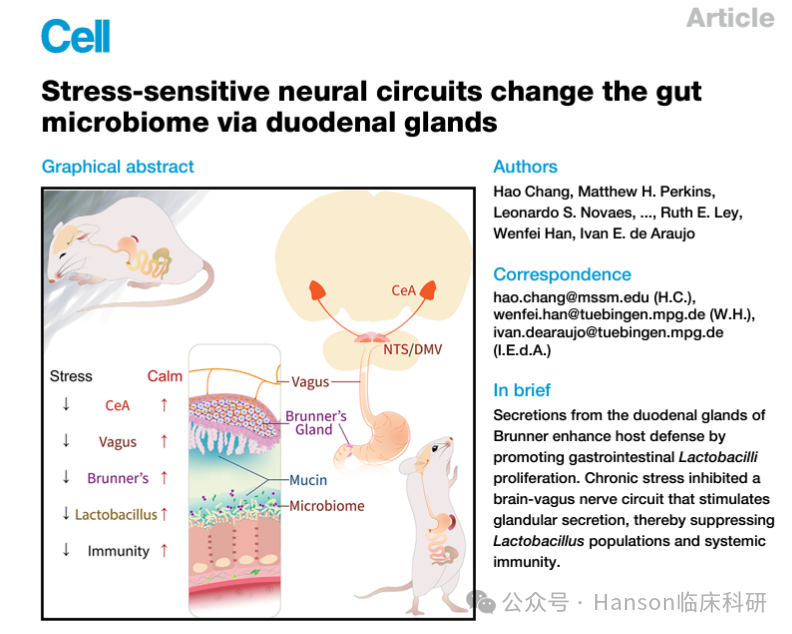
为了深入理解这一复杂的生理过程,德国马克斯普朗克生物控制学研究所的神经科学家Ivan de Araujo及其团队完成并发表了题为“Stress-sensitive neural circuits change the gut microbiome via duodenal glands”的文章,研究聚焦于肠道中的布氏腺体(Brunner’s glands),这是一组位于小肠壁上的小器官,其功能尚不完全明确,但已知它们能够产生粘液并含有大量神经元。
研究结果表明,心理压力通过影响布氏腺体的功能,进而导致肠道微生物群失衡,特别是乳杆菌属细菌的减少,最终引发肠道炎症和免疫能力的下降。这一发现不仅为理解心理压力与健康之间的联系提供了新的视角,也为开发针对压力相关疾病的新疗法提供了潜在的靶点。

主要结果
布氏腺体与感染易感性的关系:
研究发现,移除小鼠的布氏腺体会使其对感染更加敏感,同时炎症标志物水平上升。甚至,布氏腺体切除术会导致免疫缺陷综合征,并因肠道异常感染而导致死亡。
这表明布氏腺体在维持肠道健康和免疫防御中发挥着重要作用。
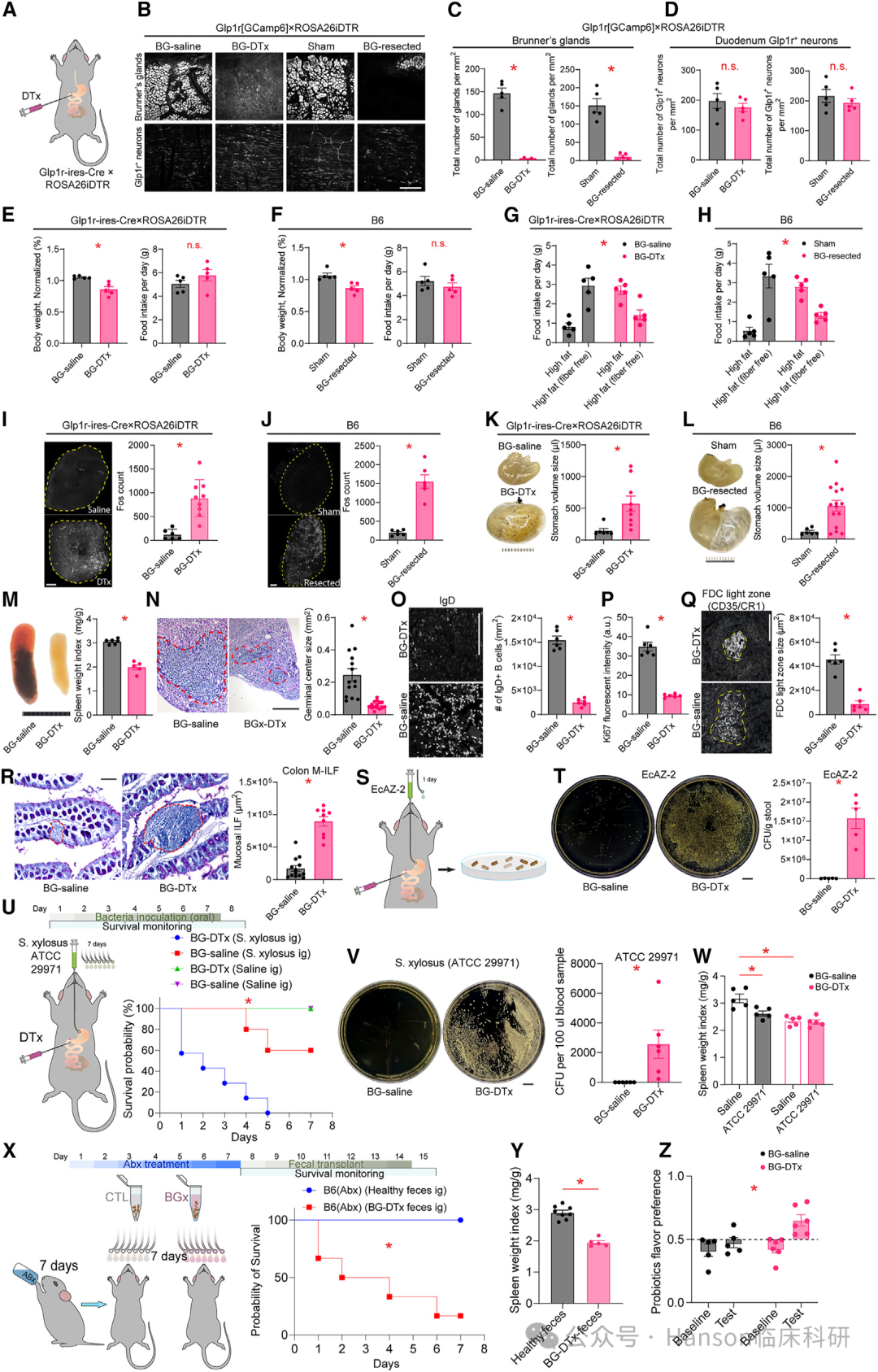
布氏腺体与肠道微生物群的关系:
研究指出,布氏腺体的移除导致小鼠肠道中乳杆菌属(Lactobacillus)细菌的数量减少。
乳杆菌属细菌在健康肠道中有助于维持肠道屏障的完整性,防止有害物质穿过肠道壁进入血液。
肠道屏障功能的变化,导致免疫性疾病:
当乳杆菌属细菌减少时,肠道屏障功能受损,导致“肠道渗漏”,使得本不应该进入血液的物质穿过肠道壁,引发免疫系统的攻击反应,从而产生炎症。
神经通讯途径的作用:
研究揭示了布氏腺体神经元与迷走神经之间的直接联系,这些神经元通过迷走神经纤维与大脑的杏仁体相连,杏仁体是与情绪和应激反应相关的脑区。
心理压力对布氏腺体的影响:
在慢性压力下,即使布氏腺体未被移除,小鼠的乳杆菌属细菌水平也会下降,炎症水平上升,这表明心理压力可能通过影响布氏腺体的功能来影响肠道微生物群和免疫系统。
对人类健康的潜在影响:
研究还观察到,那些曾经移除含有布氏腺体部分肠道肿瘤的人类患者,其白细胞计数(炎症的一个标志)高于其他区域肿瘤移除的患者,这暗示了类似的机制可能在人类中也存在。
益生菌和粘蛋白可恢复缺乏布氏腺动物的免疫功能并促进其生存。
综上所述,研究结果强调了心理压力、肠道微生物群和免疫系统之间复杂的相互作用,并揭示了布氏腺体在这一过程中的关键作用。
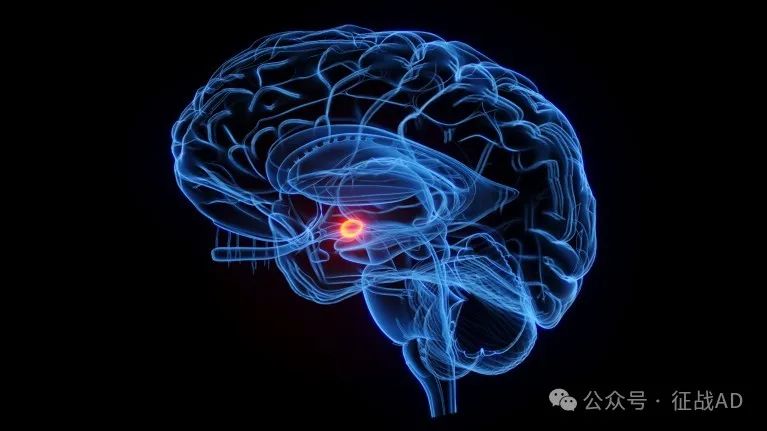
图1. 压力导致肠道微生物群的紊乱,这反过来又引起炎症和身体抵御感染能力的下降
编者按:
临床意义:
本研究揭示了心理压力通过影响肠道布氏腺体进而扰乱肠道微生物群,导致免疫系统功能下降的潜在机制,具有重要的临床意义和科研启示。
益生菌和粘蛋白可恢复缺乏布氏腺动物的免疫功能并促进其生存。
这一发现不仅增进了我们对肠道-大脑轴功能的理解,也为开发新的治疗抑郁症和焦虑症的策略、炎症性肠病提供了可能的生物学基础和新的干预策略。
研究团队目前正在研究哺乳期妇女的慢性应激是否会影响婴儿的这一通路,因为婴儿是通过母乳获取乳酸杆菌的。
科研启发:
研究结果促进了对神经-肠道-免疫轴深入研究的需求,强调了肠道微生物群与宿主健康之间的关联,推动了跨学科研究的发展,并为研究早期生活经历对长期健康影响提供了新的视角。
此外,研究结果还可能促进药物疗法与非药物疗法的结合,以及心理健康干预措施的开发,以更全面地应对压力对身体健康的影响。
期待更多类似高质量研究,给患者带来更优的临床诊疗策略。
原文链接:
【1】 Chang H, Perkins MH, Novaes LS, Qian F, Zhang T, Neckel PH, Scherer S, Ley RE, Han W, de Araujo IE. Stress-sensitive neural circuits change the gut microbiome via duodenal glands. Cell. 2024 Aug 1:S0092-8674(24)00779-7. doi: 10.1016/j.cell.2024.07.019. Epub ahead of print. PMID: 39121857.
【2】 https://doi.org/10.1038/d41586-024-02557-5


