Circulation:肺部多组学整合研究揭示了Asporin在肺动脉高压中的保护作用
时间:2024-08-25 13:00:11 热度:37.1℃ 作者:网络

研究背景
肺动脉高压(PAH)是一种无法治愈且常致命的疾病,其特点是不可逆的血管重塑。尽管在临床前阶段已经发现了许多候选药物,但能够有效逆转这种疾病进程的疗法仍然稀缺。要弥合这一转化医学的差距,需要更深入地了解人类PAH肺组织中的分子和细胞机制。
基于数据驱动的全转录组研究揭示了PAH肺组织中差异表达的基因和相关通路。然而,由于这些研究通常基于少量晚期PAH患者的肺样本,且缺乏足够的实验验证,因此这些发现是否在疾病病理生物学中具有稳健性和关键性仍不明确。此外,典型的病变与健康组织之间的差异基因表达分析无法区分哪些转录变化是有害的或有益的,或者是导致疾病还是由疾病引起的。因此,需要对PAH肺组织中的转录组进行更严格的系统级分析,并整合不同类型的组学数据,以推进对PAH病理生物学的理解,进而识别新的治疗靶点。
研究方法
在本研究中,我们利用了迄今为止规模最大的多中心PAH肺组织生物库,包含96个PAH疾病样本和52个对照样本。我们结合临床病理数据、全基因组关联研究、贝叶斯调控网络、单细胞转录组学和药物转录组学,对这些样本进行了综合的转录组分析和深度表型分析,以解析PAH的基因网络。
研究结果
结果1:PHBI 群体的特征
我们对肺移植时收集的 96 个肺动脉高压(PAH)患者的移植肺和来自 Pulmonary Hypertension Breakthrough Initiative(PHBI) 的 52 个对照肺进行了 RNA 测序(图 1A 和 1B)。我们随后使用加权基因共表达网络分析(WGCNA)对所有样本进行了分析,将肺转录组根据基因共表达划分为模块。模块将个别基因的转录变化组织成簇,代表共调控或共享的生物功能。
结果2:共表达网络分析揭示与 PAH 严重程度和遗传风险相关的模块
我们共识别出20个基因共表达模块,模块的中位基因数量为141个(图1C)。模块内基因的表达可以通过其特征基因来概括,特征基因定义为捕捉模块基因表达变化最多的第一个主成分。在模块特征基因与模块基因的平均表达方向对齐后,通过与临床病理特征的相关性分析,发现266个基因组成的粉色模块具有最显著的关联模式(图1D和1E)。该粉色模块不仅与PAH的诊断有强烈关联(图1D),而且还可以根据肺功能测试、右心导管和通过形态测量学对血管重塑的组织学分析,获得疾病严重程度的生理、血流动力学和病理标志物。在与PAH诊断呈正相关的其他模块中,包含98个基因的蓝模块与粉色模块显示了相似的临床病理相关性模式(图1D和1E)。而包含290个基因的绿黄色模块与PAH诊断的负相关性最强。粉色模块和蓝模块也是在PAH肺组织中基因上调最显著的两个模块,而绿黄色模块则最显著地富集于下调基因(图1F)。我们发现,只有粉色模块在使用两种不同的计算方法和多个PAH全基因组关联研究队列中,显著富集了与PAH相关的单核苷酸多态性(SNPs)(图1G)。这一发现表明,粉色模块不仅与PAH的诊断和严重程度相关,而且还富集了那些其失调可能与发展PAH的遗传风险相关的基因。我们识别出了两个可能具有保护作用的基因网络模块,这些模块与血管细胞相关。
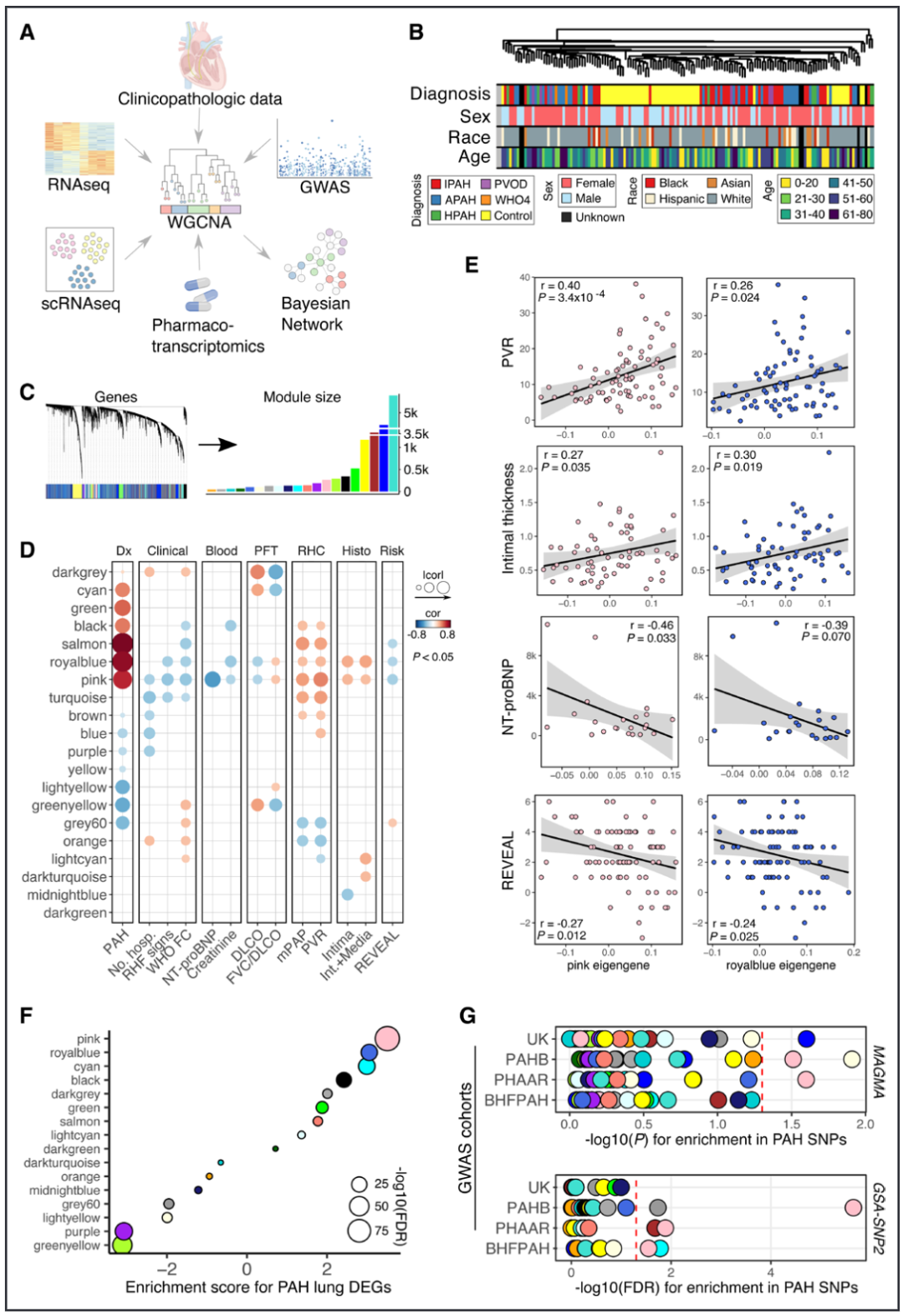
图 1.共表达网络分析揭示了与肺动脉高压严重程度和遗传风险相关的模块。
结果3:粉色和蓝模块与血管细胞类型相关
为了推断这些模块可能涉及的细胞类型,我们使用了来自7个公开的人类肺单细胞RNA测序数据集整合的37种肺细胞类型簇的转录组参考,进行了解卷积分析(图2A–2C)。利用这一肺图谱作为参考,我们用CIBERSORTx对PAH和对照样本的转录组进行了解卷积分析,观察到PAH样本和对照样本在估计的细胞比例基础上形成了不同的聚类(图2D和2E)。随后,我们将解卷积后的细胞比例与我们的共表达模块整合,通过将细胞比例与模块特征基因在样本间的相关性进行比对。与临床病理相关性分析类似,粉色和蓝模块在细胞类型的关联中也聚集在一起,显示出各种血管细胞比例的正相关(图2F和2G)。为了进一步推断细胞和组织特异性,我们使用了HuBMAP联盟提供的773种细胞类型在23种组织中的已知基因标记进行基因集富集分析,发现粉色和蓝模块的标记在所有主要血管细胞类型中富集,特别是在肺部(图2H)。进一步研究发现,编码asporin的ASPN基因是一个关键的网络枢纽基因,其在PAH中表达上调,可能作为一种代偿性反应来抵抗疾病进展。
注:Asporin是一种在人体中发现的蛋白质,属于小分子量蛋白多糖(small leucine-rich proteoglycans, SLRPs)家族。它主要存在于软骨和结缔组织中,参与了多种生物过程,包括细胞外基质的形成和调节。Asporin由ASPN基因编码。Asporin在软骨、骨骼和其他结缔组织中发挥重要作用。具体功能包括:1)调控骨矿化:Asporin可以通过影响转化生长因子-β(TGF-β)信号通路,调控骨骼和软骨的形成;2)软骨退行性变:Asporin在骨关节炎等软骨退行性疾病中被认为有一定的参与作用。某些Asporin基因的多态性(如D14等位基因)与骨关节炎的易感性有关;3)调节细胞外基质:Asporin影响细胞外基质的组装和降解,调节组织修复和再生。临床相关性:Asporin在一些病理条件下发挥重要作用,特别是在骨关节炎、纤维化、癌症等疾病中。由于其对软骨和结缔组织的影响,它是研究骨骼疾病和软骨相关问题的一个重要靶点。因此,Asporin是一个在细胞外基质组织中起关键作用的蛋白质,特别是在骨骼和软骨的健康与疾病中扮演了调控角色。
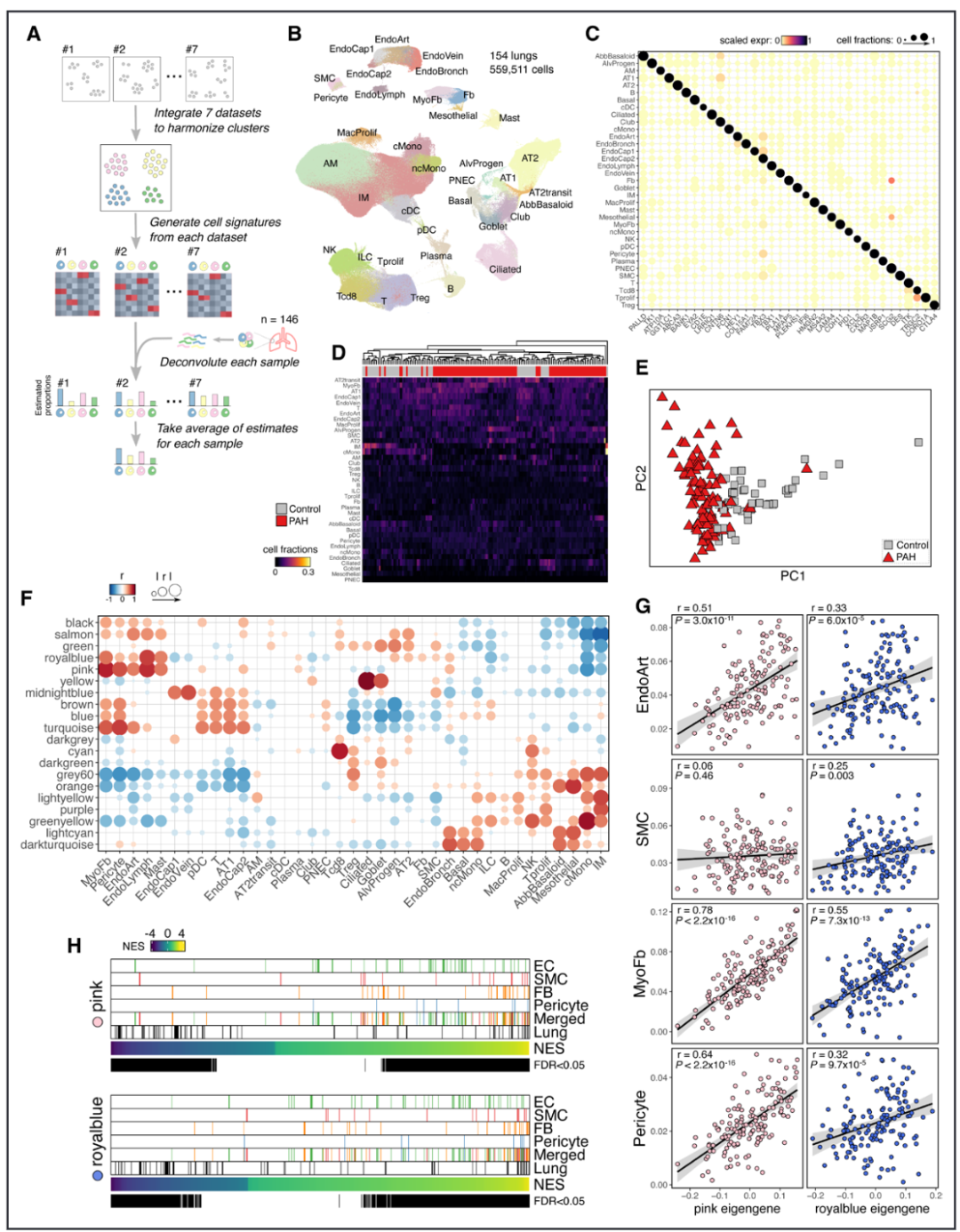
图 2. 粉色和蓝色模块与血管细胞类型相关。
结果4:粉色和蓝模块共享 PAH 相关通路和药物特征
由于粉色和蓝模块在PAH严重程度和血管细胞的关联性上相似,我们推测这两个模块尽管由不重叠的基因组成,却可能涉及趋同的通路。我们使用了京都基因和基因组百科全书(KEGG)数据库中的320个注释通路进行了基因集富集分析,发现粉色模块和蓝模块的富集评分之间具有高度相关性(r=0.79),特别是在PAH相关的通路如转化生长因子(TGF)-β信号通路中(图3A)。
接下来,我们探索了粉色和蓝模块标记与已知药物标记的模式匹配情况,以探讨它们在PAH中的潜在作用和调控。我们将模块标记与来自ConnectivityMap(CMap)的2429种药物标记进行了筛选,发现JAK(Janus激酶)和CDK(细胞周期蛋白依赖性激酶)抑制剂,这两种药物最近作为PAH的潜在治疗方案进行了研究,是与粉色和蓝模块标记最匹配的药物类别(图3B)。这表明粉色和蓝基因之间存在趋同且可靶向的通路。相比之下,绿黄色模块作为下调差异表达基因最丰富的模块,并未显示出强烈的CMap匹配特征。
考虑到JAK和CDK抑制剂可能在PAH中具有治疗作用,并且粉色和蓝模块的特征基因与临床上有利的疾病预后指标相关联,我们假设粉色和蓝基因可能在PAH中具有保护作用。
结果5:ASPN 是与粉色和蓝色模块紧密相关的顶级枢纽基因
为了描绘粉红色和蓝模块内基因之间的调控关系,我们使用了贝叶斯网络方法,通过整合2066个肺转录组、肺特异性表达定量性状位点(eQTLs)和已知的转录因子-靶基因关系,构建了一个人类肺的基因调控网络(图3C)。将所有共表达模块基因投射到该肺基因调控网络上显示,同一模块的基因在网络中彼此接近,表明共表达和调控网络捕捉到了相似的基因-基因关系。我们发现,多个已知的PAH(肺动脉高压)基因与粉红色模块基因在基因调控网络中共定位,暗示粉红色模块基因在已知的PAH病理生物学中具有调控作用(图3D)。例如,BMPR2是最为确立的PAH致病基因,它被预测调控了一个上调的粉红色模块基因GUCY1A2,我们在公开的RNA测序(RNA-seq)数据集中验证了这一预测。进一步支持粉红色模块基因在PAH中可能有益的证据是,GUCY1A2编码可溶性鸟苷酸环化酶1(sGC1)的一个亚单位,而sGC1是目前临床用于治疗PAH的sGC刺激剂药物利奥西呱的主要靶点。鉴于粉红色和蓝模块在临床病理、药理学、细胞类型和通路关联方面的相似模式,我们研究了蓝基因是否与粉红色基因存在调控关系。我们发现有12个蓝基因在粉红色子调控网络中共定位,其中包括那些已被证明与PAH相关的基因(如CXCL12、COL1A2、CFH、APLNR)以及最近被确定为PAH的生物标志物LTBP2(图3D)。在这些蓝基因中,ASPN、LTBP2和APLN被鉴定为蓝和粉红色模块的枢纽基因,其依据是加权基因共表达网络分析中两个模块的连接度得分均大于0.7。这表明这些枢纽基因与两个模块的基因呈高度共表达,可能在这些模块的分子通路中发挥重要作用。ASPN编码小富含亮氨酸的蛋白聚糖Asporin,是这三个枢纽基因中唯一一个之前未与PAH相关联的基因,并且它与PAH诊断的相关性最强(图3E和3F)。PAH患者肺中的ASPN mRNA水平与较高的肺血管阻力(PVR)和较低的REVEAL死亡风险评分相关(图3G和3H),这与粉红色和蓝模块中的模块级相关性相似。此外,ASPN是PAH转录组中上调的差异表达基因之一,这一发现不仅在我们数据集中的全肺样本中一致存在,而且在一个独立数据集的远端肺动脉中也得到了验证(图3I和3J)。这些结果与通过我们的去卷积和细胞类型富集分析所推断出的粉红色和蓝模块的血管细胞特异性一致。为了进一步分析,我们查询了scRNA-seq数据集,发现ASPN在间充质细胞(如平滑肌细胞,SMCs)中表达最多,无论是在Tabula Sapiens最近发布的人体单细胞图谱中,还是在我们自定义整合的肺图谱中(图3K)。支持我们的药物预测和ASPN的潜在保护作用,我们用CMap分析中预测的CDK抑制剂治疗了PAH肺动脉平滑肌细胞(PASMCs),发现ASPN mRNA水平呈剂量依赖性上升(图3L)。
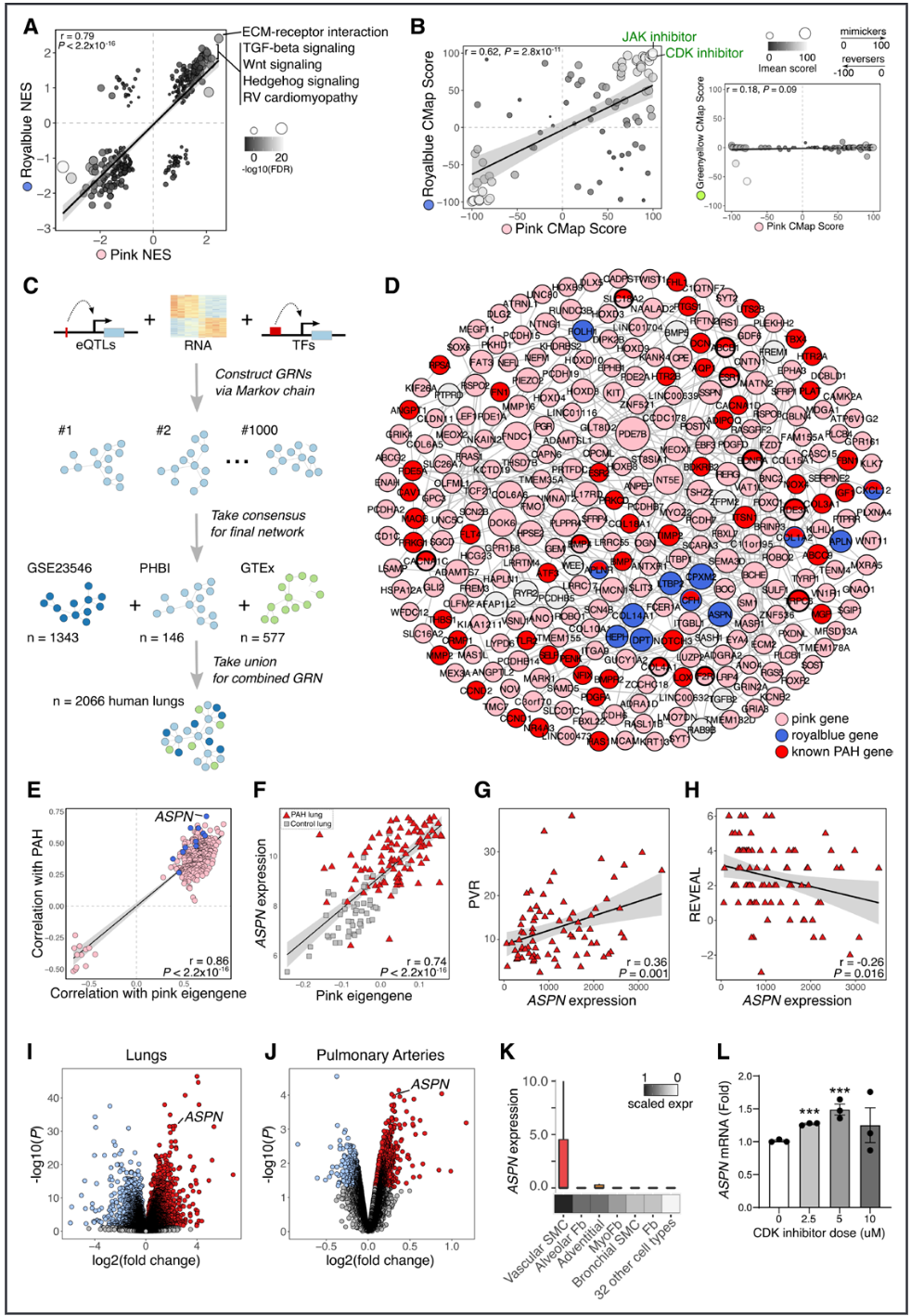
图 3. 粉色和蓝模块共享肺动脉高压相关通路、药物概况和中心基因 ASPN。
结果6:ASPN在多个PAH(肺动脉高压)队列中上调,与良好的临床特征相关联,并可能与已知的PAH风险基因受到相似的遗传调控。
在我们优先研究粉红色和蓝模块并将ASPN确定为这两个模块的关键枢纽基因之后,我们进一步探讨了ASPN在PAH(肺动脉高压)中可能具有保护作用的假设。首先,我们通过定量聚合酶链式反应验证了在晚期PAH患者切除的肺组织中,ASPN mRNA的上调(图4A)。接下来,我们评估了在原位肺组织中asporin蛋白的表达,发现asporin与平滑肌细胞标志物α-平滑肌肌动蛋白共定位,并且在PAH患者的远端肺动脉中层相较于对照组显著上调(图4B)。我们还发现,asporin在原位肺动脉平滑肌细胞中的表达与这些患者的平均肺动脉压呈负相关(图4C)。此外,ASPN mRNA在全血中也上调,并在我们查询的伦敦PAH患者队列的RNA-seq数据中与心输出量呈正相关(图4D和4E)。由于asporin是一种直接分泌到细胞外环境中的蛋白质,我们在加利福尼亚大学洛杉矶分校的另一个具有不同疾病严重程度的肺动脉高压患者队列中测量了循环血浆中的asporin水平,结果发现PH患者的血浆asporin蛋白水平较对照组更高(图4F),并且与较好的右心室功能相关,而右心室功能是PAH症状和生存的主要决定因素。血浆asporin水平与心输出量和右心室面积变化率呈正相关,并在三尖瓣环平面收缩位移中表现出相关趋势(图4G-4I)。这些数据不仅表明asporin作为一种新型PAH生物标志物的潜力,还支持其在PAH中可能具有的保护作用。
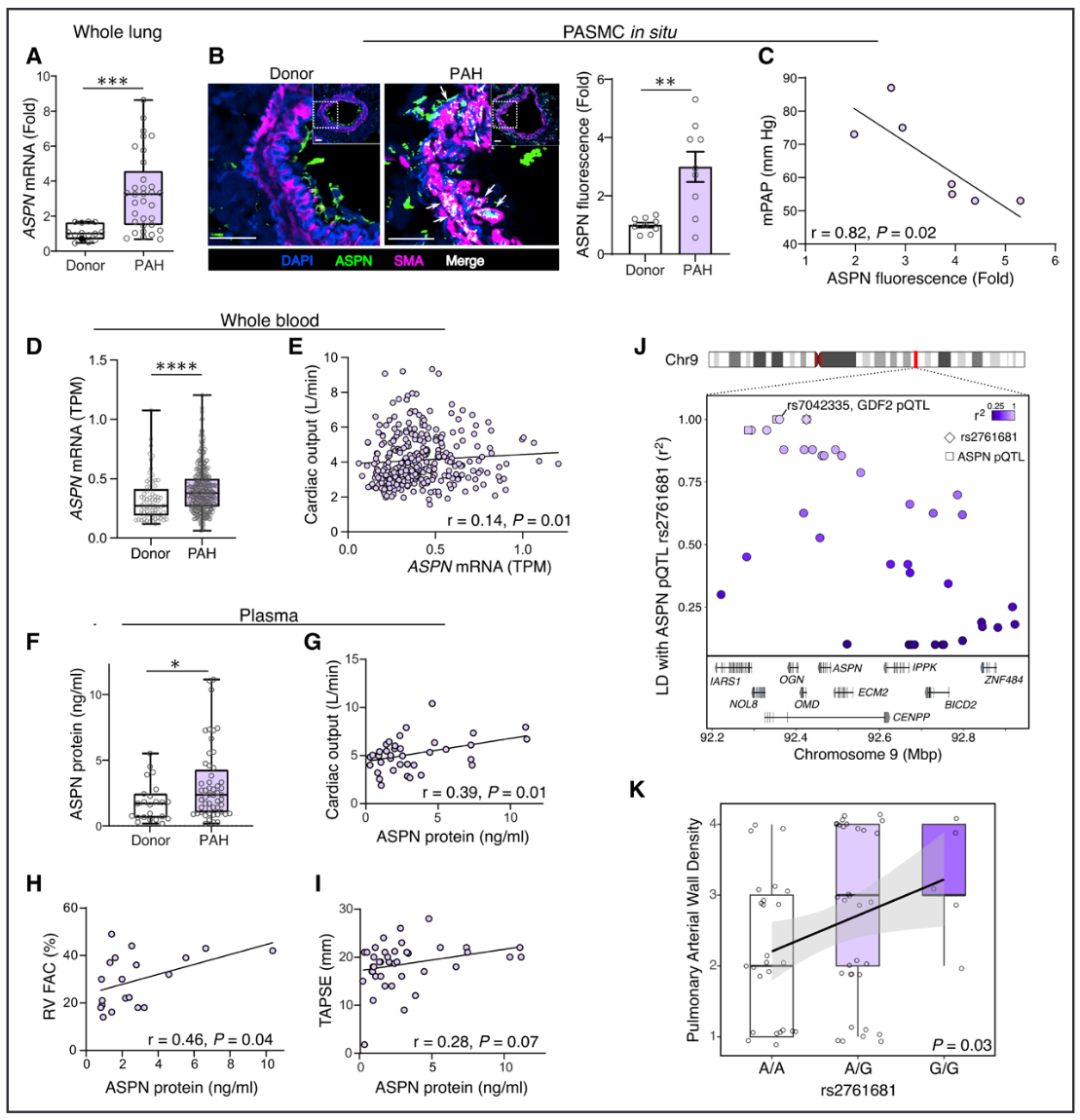
图 4. ASPN 在多个肺动脉高压队列中表达上调,与有利的临床特征相关,并且可能与已知的肺动脉高压风险基因处于类似的遗传调控之下。
在对ASPN进行mRNA和蛋白质水平的研究后,我们接下来探索了是否存在遗传证据支持ASPN在PAH(肺动脉高压)中的相关性。我们发现,ASPN血浆蛋白的主要定量性状位点rs2761681,其中次等位基因G与较低的asporin蛋白水平相关,与GDF2血浆蛋白的定量性状位点rs7042335完全连锁不平衡(r²=1),这表明ASPN和已知的PAH风险基因可能存在共享的上游遗传调控(图4J)。此外,PHBI基因型数据分析显示,rs271681的次等位基因(图4G)与通过肺组织切片的形态测量分析得到的肺动脉壁密度增加相关(图4K)。因此,rs271681[G]不仅与独立的蛋白组学队列中较低的血浆asporin蛋白水平相关,还与我们PHBI队列中的血管重塑增加相关。
结果7:缺氧可上调 ASPN,而 ASPN 缺乏会促进 PASMCs 的病理表型
考虑到PASMCs(肺动脉平滑肌细胞)失调被认为在PAH的病理血管重塑中发挥核心作用,我们接下来评估了ASPN在PASMCs中的潜在机制和功能角色。与供体肺相比,PAH肺中分离的PASMCs的ASPN mRNA和蛋白质水平显著上调(图5A和5B)。PAH患者肺中的PASMCs具有假低氧表型。因此,我们从Harmonizome中的ChEA数据库进行验证,以识别可能与ASPN启动子结合的低氧反应转录因子。我们确定了STAT5A(信号转导和转录激活因子5A)作为潜在的低氧反应转录因子。我们确认低氧诱导了供体PASMCs中STAT5A的上调。接下来,我们使用小干扰RNA(siRNA)在供体PASMCs中敲低STAT5A,并将其暴露于低氧环境中24小时。在常氧和低氧条件下,STAT5A的敲低导致ASPN表达减少,其中低氧诱导的ASPN上调在STAT5A siRNA处理的细胞中明显低于对照组。这些发现表明,在PASMCs中,ASPN的表达部分受到低氧反应转录因子STAT5A的调控,而STAT5A水平降低与PAH的发病机制相关。
为了在体外模拟这种PAH表型,我们将供体PASMCs置于3% O₂的低氧环境中,并与21% O₂的常氧条件进行比较。我们观察到,低氧条件下ASPN mRNA和蛋白质在供体PASMCs中上调(图5C和5D)。进一步研究低氧下潜在的调控机制发现,钴氯化物通过稳定低氧诱导因子模拟低氧,但未能在供体PASMCs中诱导ASPN的表达。这一发现表明,ASPN不受低氧诱导因子的调控,其启动子不太可能被这些因子直接调控。
结果8:Asporin结合TGF-β并抑制其下游信号传导和细胞增殖
由于ASPN是一种小富含亮氨酸的蛋白聚糖,它通过蛋白质-蛋白质相互作用发挥功能,我们评估了已知的ASPN相互作用,以研究ASPN可能如何对抗PAH的潜在通路和机制。分析STRING数据库显示,TGF-β1是ASPN的主要结合伙伴。为此,我们进行了CO-IP实验,确认了ASPN在PAH的PASMCs中与TGF-β1结合(图5I)。虽然异常的TGF-β信号传导被认为是PAH中导致血管细胞促增殖表型的关键病理机制,已有研究表明,ASPN对TGF-β信号的影响可能因细胞类型和疾病背景的不同而有所不同,可以抑制或促进TGF-β信号传导。因此,我们接下来研究了ASPN在PAH PASMCs中对TGF-β信号的作用,发现ASPN的siRNA敲低导致PAH PASMCs中磷酸化SMAD2/3的表达增加,SMAD2/3是TGF-β的促增殖和抗凋亡效应因子(图5J)。这些结果表明,ASPN可能通过直接结合TGF-β1并抑制PAH PASMCs中的下游TGF-β信号传导来对抗PAH。考虑到TGF-β在调节成纤维细胞功能中发挥关键作用,而ASPN在肺的单细胞RNA测序中被检测到在成纤维细胞中(图3K),我们还研究了ASPN在PAH外膜成纤维细胞中的功能效应。我们的发现显示,ASPN的敲低导致成纤维细胞增殖增加,这与在PASMCs中观察到的现象类似。
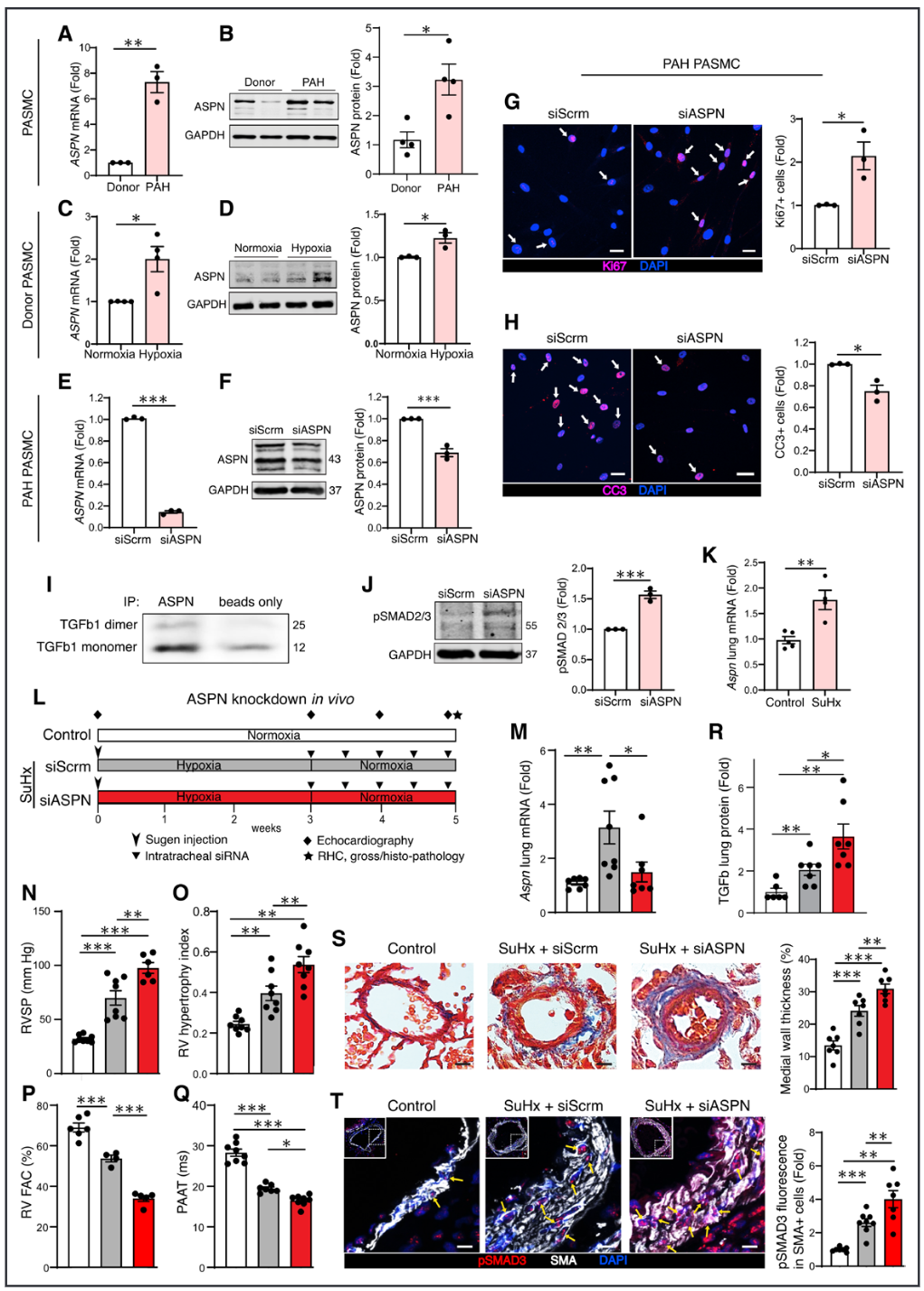
图 5. ASPN 受肺动脉高压触发因素上调,且 ASPN 缺乏会促进 Sugen 缺氧大鼠的肺动脉平滑肌细胞增殖、转化生长因子-β 信号传导和肺动脉高压。
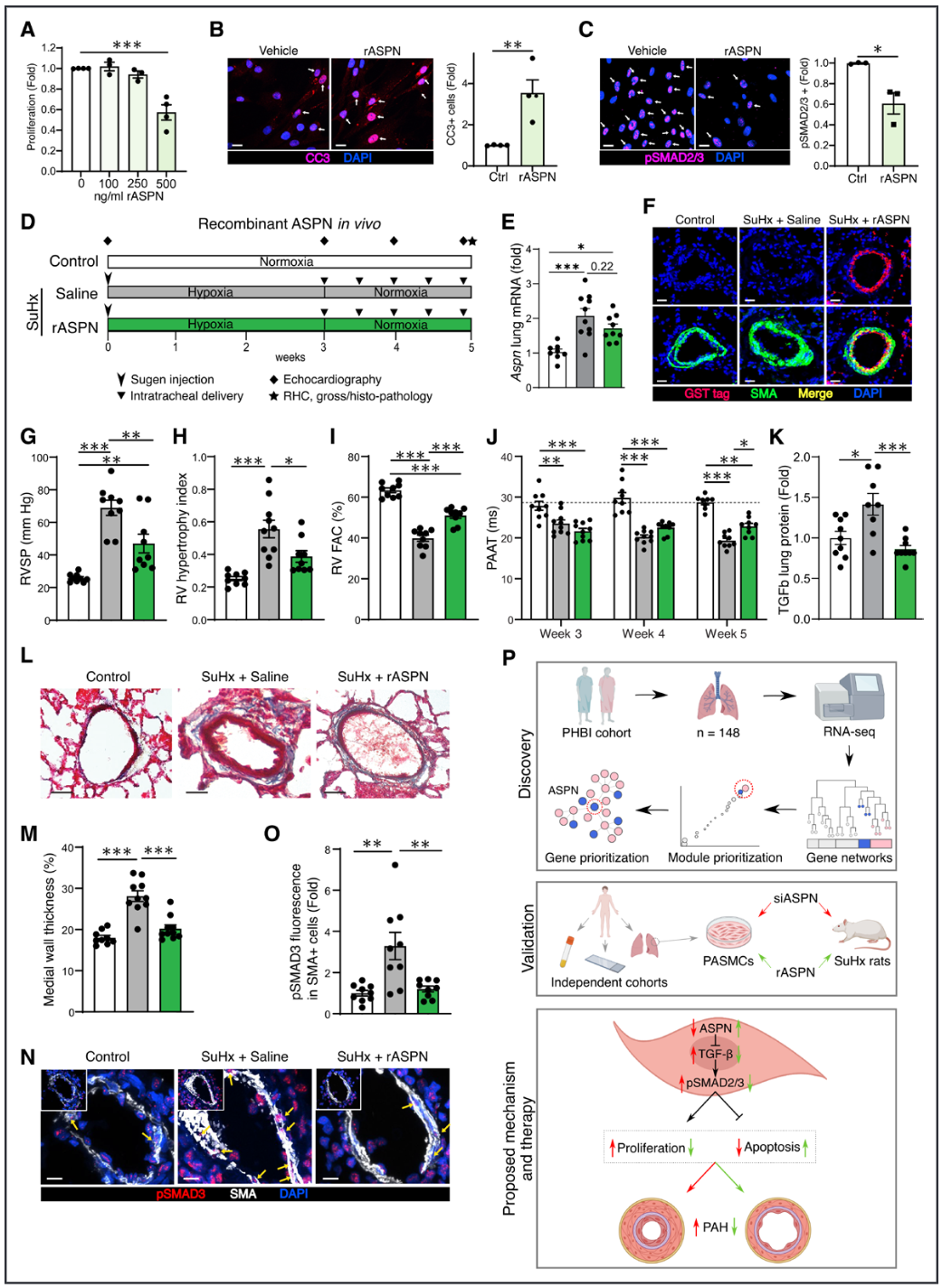
图6.重组Asporin减弱SuHx大鼠的肺动脉平滑肌细胞增殖、转化生长因子-β信号传导和肺动脉高压。
结果10:重组Asporin在体外抑制增殖和TGF-β信号传导
在展示了ASPN缺乏对PAH的不良影响之后,我们接下来探讨了增加ASPN的治疗潜力。我们在体外用不同剂量的重组ASPN蛋白(rASPN)处理PAH患者的PASMCs,发现增殖呈剂量依赖性减少(图6A)。此外,rASPN的处理促进了细胞凋亡(图6B),并抑制了PAH PASMCs中的TGF-β信号传导(图6C)。综合来看,rASPN在体外减轻了PAH PASMCs的病理表型。同样,rASPN也抑制了PAH外膜成纤维细胞的增殖。
结果11:重组Asporin在SuHx大鼠体内减轻PAH
我们评估了rASPN在体内前临床PAH模型中的治疗作用。我们在疾病建立后的3周低氧期结束时,通过气管内注射rASPN或生理盐水处理SuHx大鼠(图6D)。通过His-tag免疫荧光染色,我们确认rASPN被送达肺部,并在远端肺动脉中层中与平滑肌细胞标志物α-平滑肌肌动蛋白共定位,而不影响内源性ASPN的表达(图6E和6F)。与生理盐水处理的SuHx大鼠相比,rASPN治疗显著改善了右心室收缩压、右心室肥厚、右心室面积变化率和肺动脉加速时间(图6G–6J)。与改善的血流动力学和右心室指标一致,rASPN治疗的SuHx大鼠肺部显示出较少的TGF-β蛋白、血管重塑和PASMCs中的TGF-β信号传导,这些通过组织学评估表现为远端肺动脉中层壁厚度减少、周围血管纤维化减少以及磷酸化SMAD3在SMA+细胞中的表达减少,所有这些都与对照大鼠相当(图6K–6O)。综上所述,这些数据展示了ASPN在前临床PAH模型中的治疗潜力。
研究结论
我们的研究利用了迄今为止最大的肺动脉高压(PAH)肺组织生物库,通过对PAH肺转录组的整合系统生物学分析,我们发现了asporin作为一种新型保护性靶点,并且其具有治疗PAH的潜力。我们验证了asporin在多个独立的PAH患者队列中的肺和血浆样本中表达上调,并且这种上调与PAH的严重程度降低相关。研究还显示,asporin能够抑制来自PAH肺的肺动脉平滑肌细胞的增殖,并阻断转化生长因子-β/磷酸化SMAD2/3信号通路。此外,在Sugen-缺氧大鼠模型中,我们发现敲减ASPN基因会加重PAH,而重组asporin则能够减轻PAH症状。这一发现为PAH的治疗提供了新的方向,并可能推动更有效的治疗方法的开发。
参考文献:
Hong J, Medzikovic L, Sun W, Wong B, Ruffenach G, Rhodes CJ, Brownstein A, Liang LL, Aryan L, Li M, Vadgama A, Kurt Z, Schwantes-An TH, Mickler EA, Gräf S, Eyries M, Lutz KA, Pauciulo MW, Trembath RC, Perros F, Montani D, Morrell NW, Soubrier F, Wilkins MR, Nichols WC, Aldred MA, Desai AA, Trégouët DA, Umar S, Saggar R, Channick R, Tuder RM, Geraci MW, Stearman RS, Yang X, Eghbali M. Integrative Multiomics in the Lung Reveals a Protective Role of Asporin in Pulmonary Arterial Hypertension. Circulation. 2024 Aug 21. doi: 10.1161/CIRCULATIONAHA.124.069864. Epub ahead of print. PMID: 39167456.


