Nature 子刊:提高ALK靶向药治疗神经母细胞瘤效果的新策略
时间:2024-08-29 18:05:24 热度:37.1℃ 作者:网络
神经母细胞瘤是儿童期颅外实体瘤中最常见的一种,多数患儿被诊断为复发/难治性(r/r)型NB,该类型预后差,目前仍然缺乏有效的治疗方案。当前靶向治疗的飞速发展为NB患儿的精准治疗提供了方向,能够帮助患儿提高生存质量、延长生存期。
目前ALK蛋白被证明是神经母细胞瘤的重要的致癌驱动因子,因而ALK成为治疗神经母细胞瘤的潜在靶点。然而,由于固有和获得性耐药,ALK TKIs单药的治疗效果并不理想,因此,探索新型ALK TKIs的联合用药策略迫在眉睫。
2024年4月,由 Suzanne D. Turner 和 G. A. Amos Burke 团队发表于Nature Communications 题为 Targeting NRAS via miR-1304-5p or farnesyltransferase inhibition confers sensitivity to ALK inhibitors in ALK-mutant neuroblastoma 的文章,通过全基因组CRISPR-Cas9敲除(GecKO)技术,筛选鉴定出异常表达ALK的NB细胞中调节ALK-TKI敏感性的主要基因和信号通路。研究结果显示,miR-1304-5p是一种NB肿瘤抑制因子和ALK-TKI敏感性的调节因子,能靶向抑制癌性NRAS诱导NB细胞发生细胞凋亡,该研究提出了基于miRNA或法尼基转移酶抑制剂(FTI)通过靶向NRAS以增敏ALK抑制剂的联合治疗策略,对改善ALK异常表达的(r/r)NB的预后具有重要意义。

首先,作者对NB细胞进行了GeCKO的系列筛选,以探索表达抑制时使NB细胞对ALK TKIs发生耐受的基因,这些基因及其所在的信号通路可能在NB对ALK TKIs敏感性的调控中发挥肿瘤抑制因子的作用,从而提示了药物联合治疗的潜在靶点。研究团队筛选出4种miRNA (hsa-mir-136、hsa-mir-1304、hsa-mir-7975和hsa-mir-4746)进行了深入的研究。
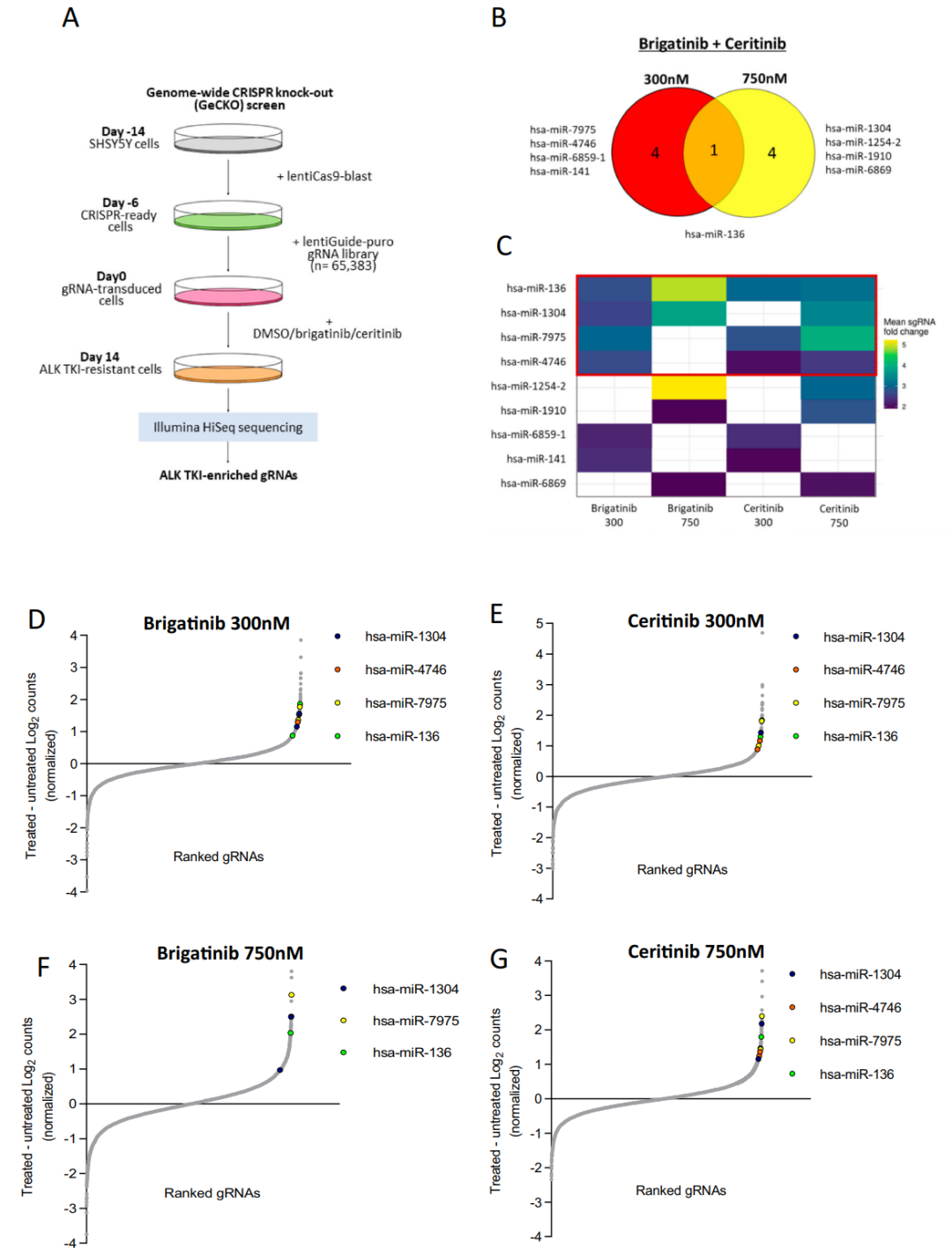
图1.在神经母细胞瘤SH-SY5Y细胞中进行GeCKO筛选并鉴定影响ALK TKIs敏感性的基因,该图(A)总结了敏感性靶基因筛选的质控流程图,(B)通过GeCKO筛选鉴定的miRNA基因的Venn图,抑制这些miRNA的表达可使SH-SY5Y细胞对布加替尼或塞瑞替尼抵抗,(C)布加替尼和塞瑞替尼筛选鉴定出的miRNA靶基因热图,以及(D-G)根据DMSO或ALK TKI处理后的gRNAs进行排名,展示布加替尼和塞瑞替尼治疗中常见的miRNA sgrna (has-miR-1304, has-miR-136, hsa-miR-7975, has-miR-4746)的变化。
4种miRNA进行体外验证实验发现,只有抑制miR-1304-5p的表达能显著降低NB细胞系SH-SY5Y对ALK TKIs的敏感性。
同时,将miR-1304-5p抑制剂转染到17种不同ALK、p53和MYCN状态的NB细胞系中,发现当miR-1304-5p被抑制时,16个细胞系的活力均显著增加,而miR-1304-5p模拟物转染后导致所有NB细胞系的细胞活力显著降低,以上结果证实miR-1304-5p是NB的广谱肿瘤抑制因子。
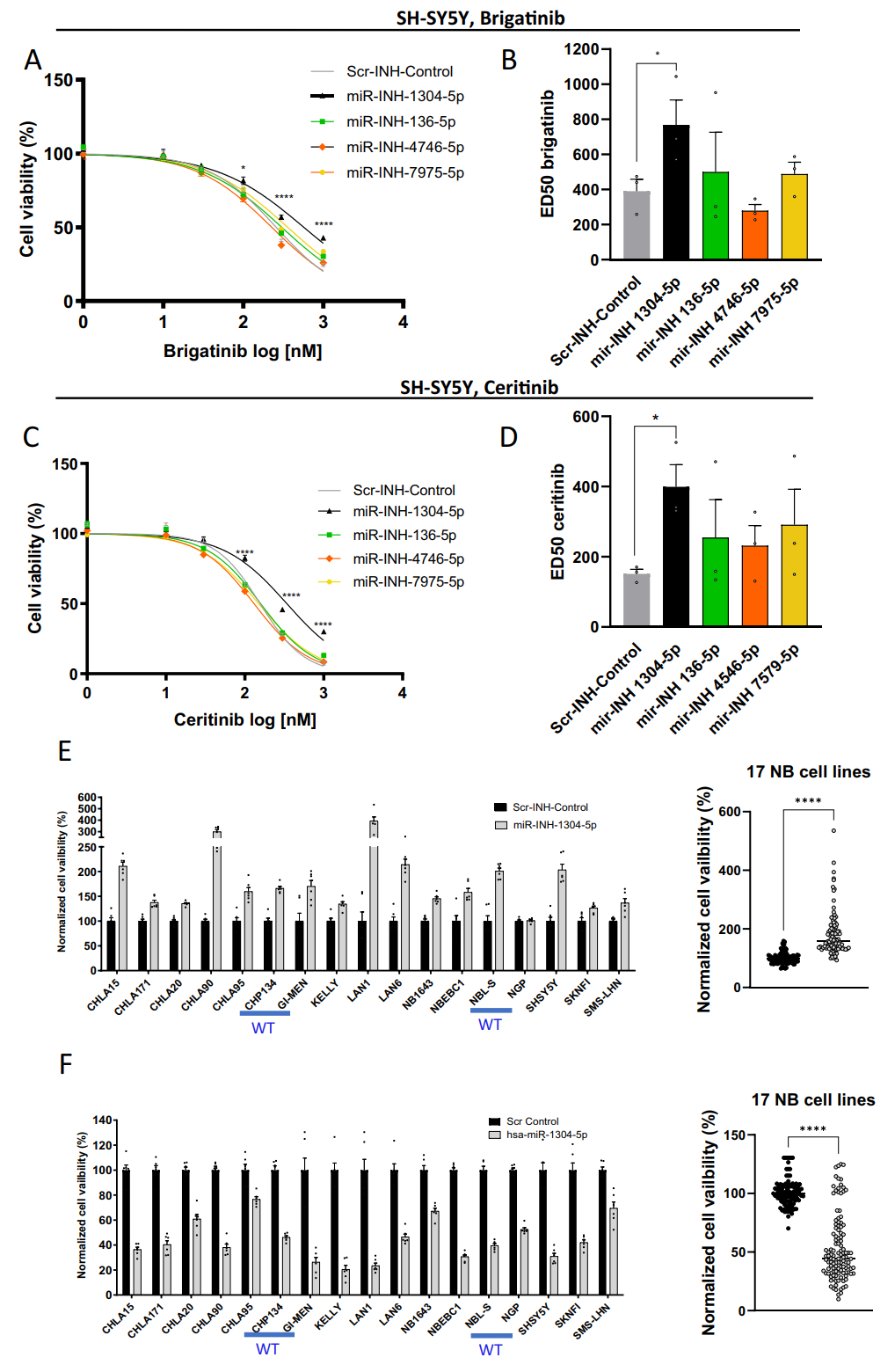
图2.miR-1304能抑制多种NB细胞系的活力,降低ALK突变NB细胞对布加替尼和塞瑞替尼的敏感性。(A -D) SH-SY5Y细胞活力和ALK TKI ED50s,(E, F)在17个NB细胞系中转染miR-1304-5p抑制剂或miR-1305-5p模拟物72小时后的细胞活力。蓝色标注ALK WT细胞,其他细胞系有激活的ALK突变。
进一步探索miR-1304-5p对NB抑制作用的分子机制,研究人员对转染了miR-1304-5p模拟物的SH-SY5Y和KELLY细胞进行了全基因组表达谱芯片分析,同时与miR-1304-5p的靶基因预测( Target Scan)结果进行综合分析,根据实验结果进行RT-qPCR和Western blot验证,发现miR-1304-5p对RAS/MAPK信号通路中NRAS、RRAS、PTPN11和IQGAP1蛋白的表达的调控作用,其中NRAS表达水平在NB患者中与不良的临床预后显著相关,并且在耐药的原位NB异种移植模型中显著上调,而RRAS、IQGAP1和PTPN11的表达没有显著的预后价值。后续体外实验证明,敲低NRAS与转染miR-1304-5p模拟物均能使布加替尼和西瑞替尼在SH-SY5Y中的ED50显著降低,以上多种证据表明,NRAS是miR-1304-5p增敏ALK-TKI的重要作用靶点,因而,作者进一步研究了其作为ALK-TKI联合治疗靶点的潜力。
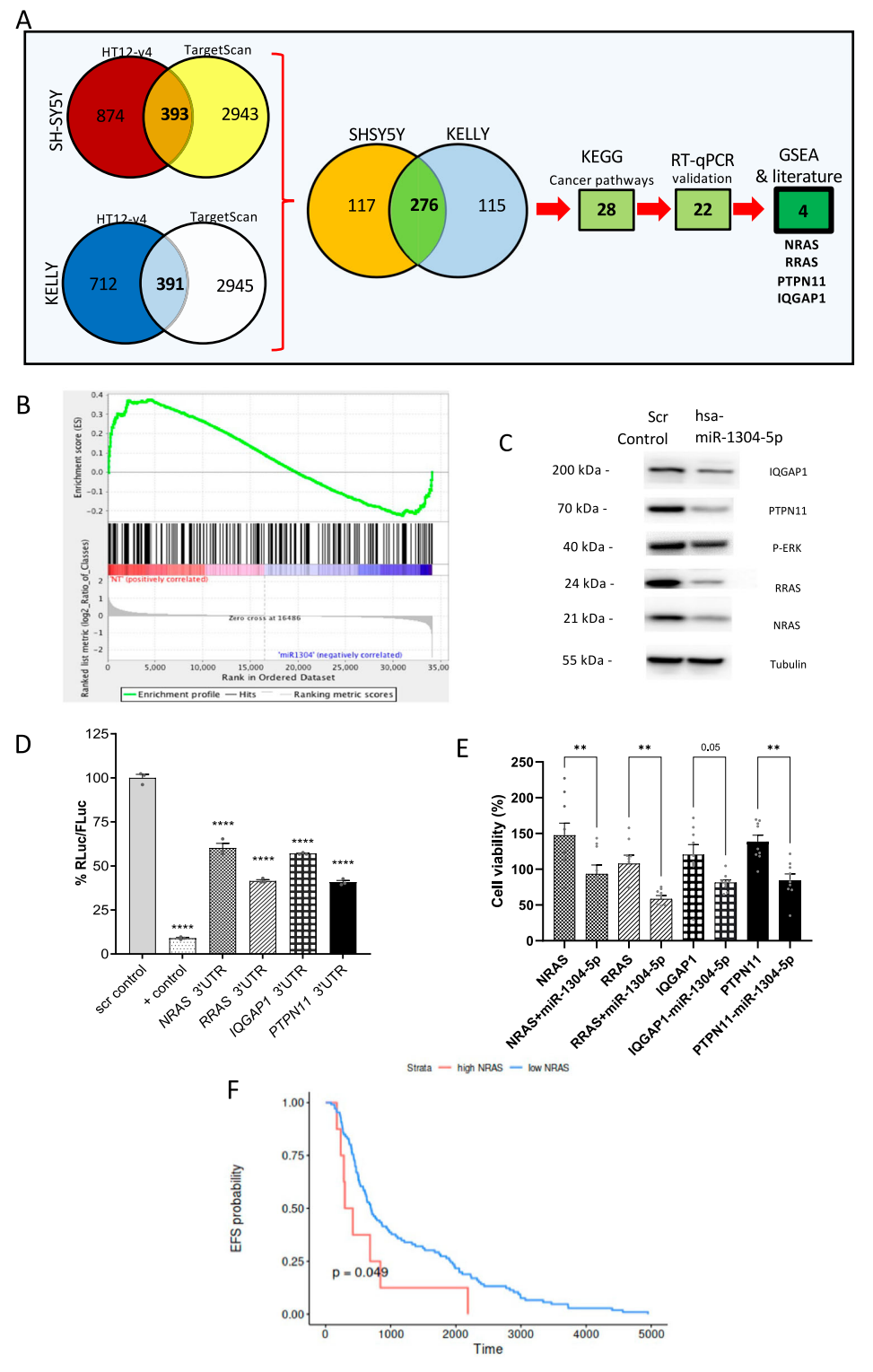
图3.miR-1304-5p抑制NRAS表达。(A)筛选miR-1304-5p靶基因的实验流程图;(B)Hallmark_KRAS_signaling_up 富集分析(GSEA);(C)用miR-1304-5p模拟物转染SH-SY5Y细胞 72 h后对目标蛋白进行Western blot分析;(D)使用miR-1304-5p模拟转染SH-SY5Y细胞后,由4个靶基因的3'UTR的双荧光素酶检测信号对照载体的比例定量分析柱状图;(E)SH-SY5Y细胞中4个靶基因±miR-1304-5p模拟物的细胞活力定量分析柱状图。
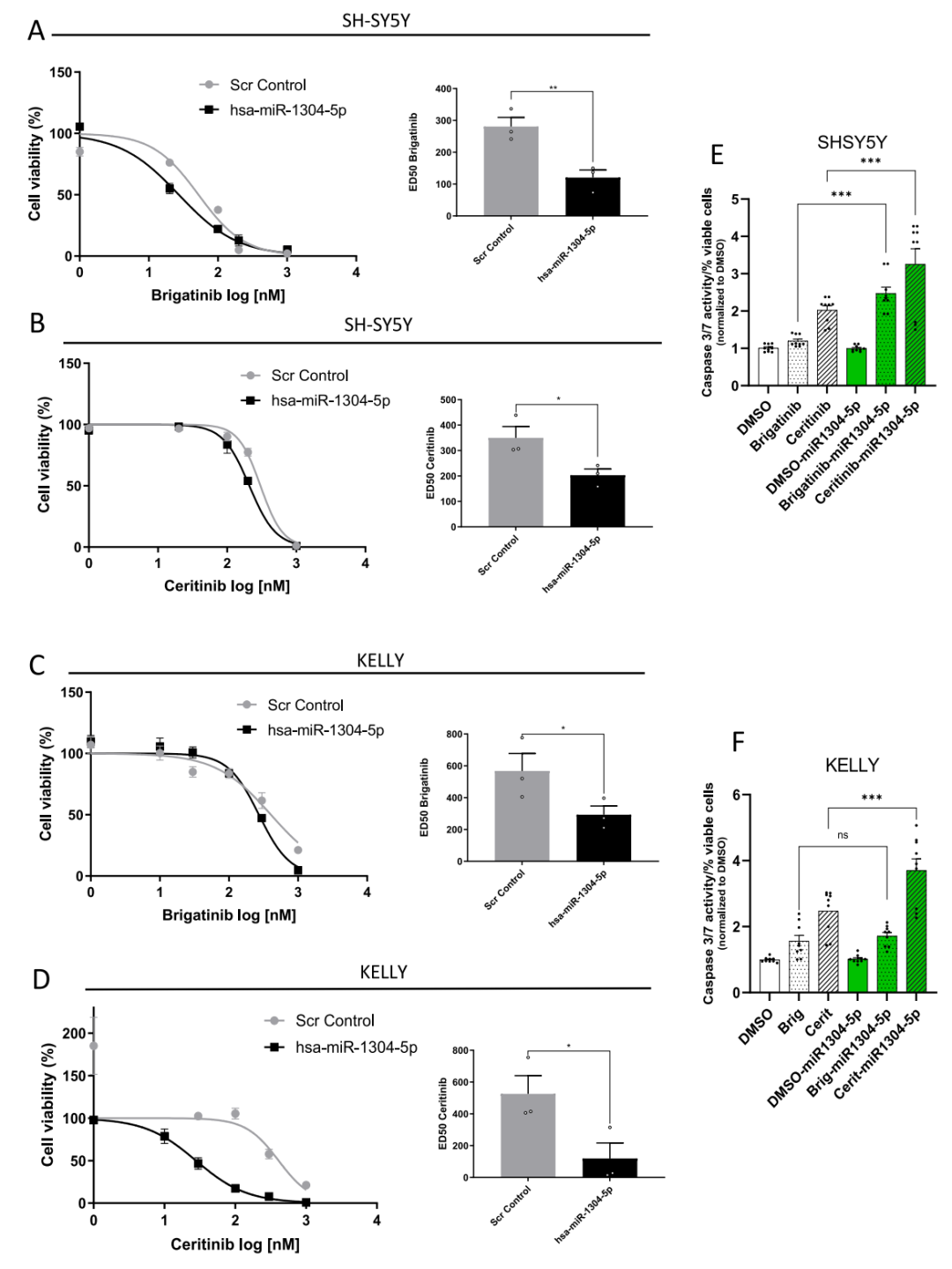
图4.转染miR-1304-5p模拟物能增敏ALK TKIs。在mir -1394-5p模拟物转染和布加替尼(SH-SY5Y (A)和KELLY (C))或西瑞替尼(SH-SY5Y (B)和KELLY (D))联合治疗72小时后检测细胞活力和ED50。
基于以上的实验结果,研究团队选择lonafarnib,一种能通过多靶点抑制RAS信号通路的口服FTI来进行后续的研究。实验结果提示,lonafarnib与ALK TKIs在在临床最大耐受剂量以内的较高浓度下出现显著的协同抑瘤作用,同时,协同作用与MYCN的扩增状态相关。
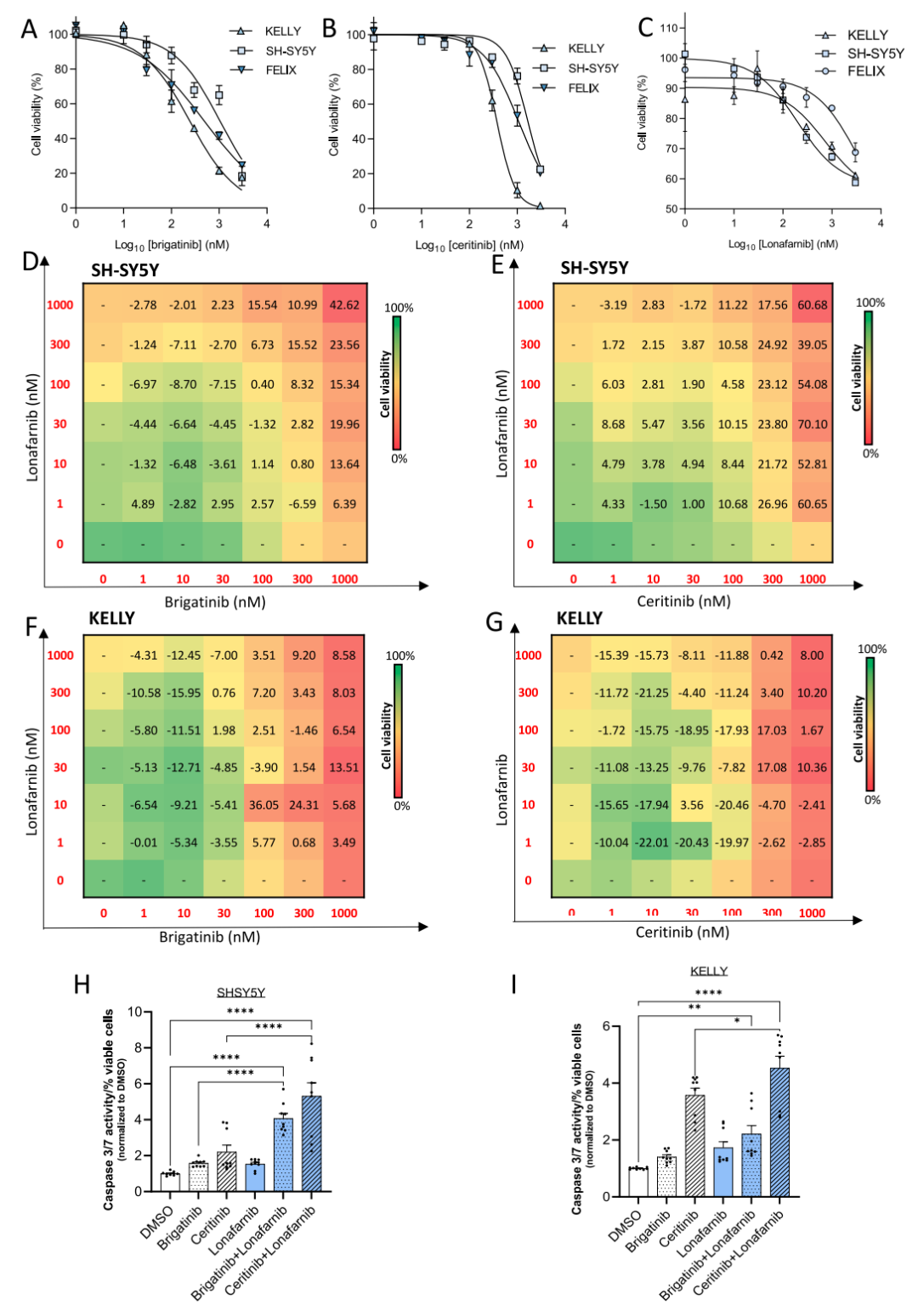
图5.ALK抑制剂和FTI在ALK异常MYCN非扩增的NB细胞系中具有协同作用。(A-C)布加替尼、塞瑞替尼或洛那替尼治疗72小时后测定SH-SY5Y、KELLY和FELIX细胞系的细胞活力。lonafarnib + brigatinib或ceritinib在SH-SY5Y (D, E)和KELLY (F, G)中联合用药或单独用药72h的剂量-反应热图。synergy score>10表示具有协同作用。(H, I)在SH-SY5Y 和KELLY细胞中,使用lonafarnib和brigatinib或ceritinib联合或单药处理48小时测定caspase 3/7活性。
接着,研究团队在3种具有ALK突变的高风险NB患者来源的异种移植模型中亦观察到显著的协同抑瘤作用。
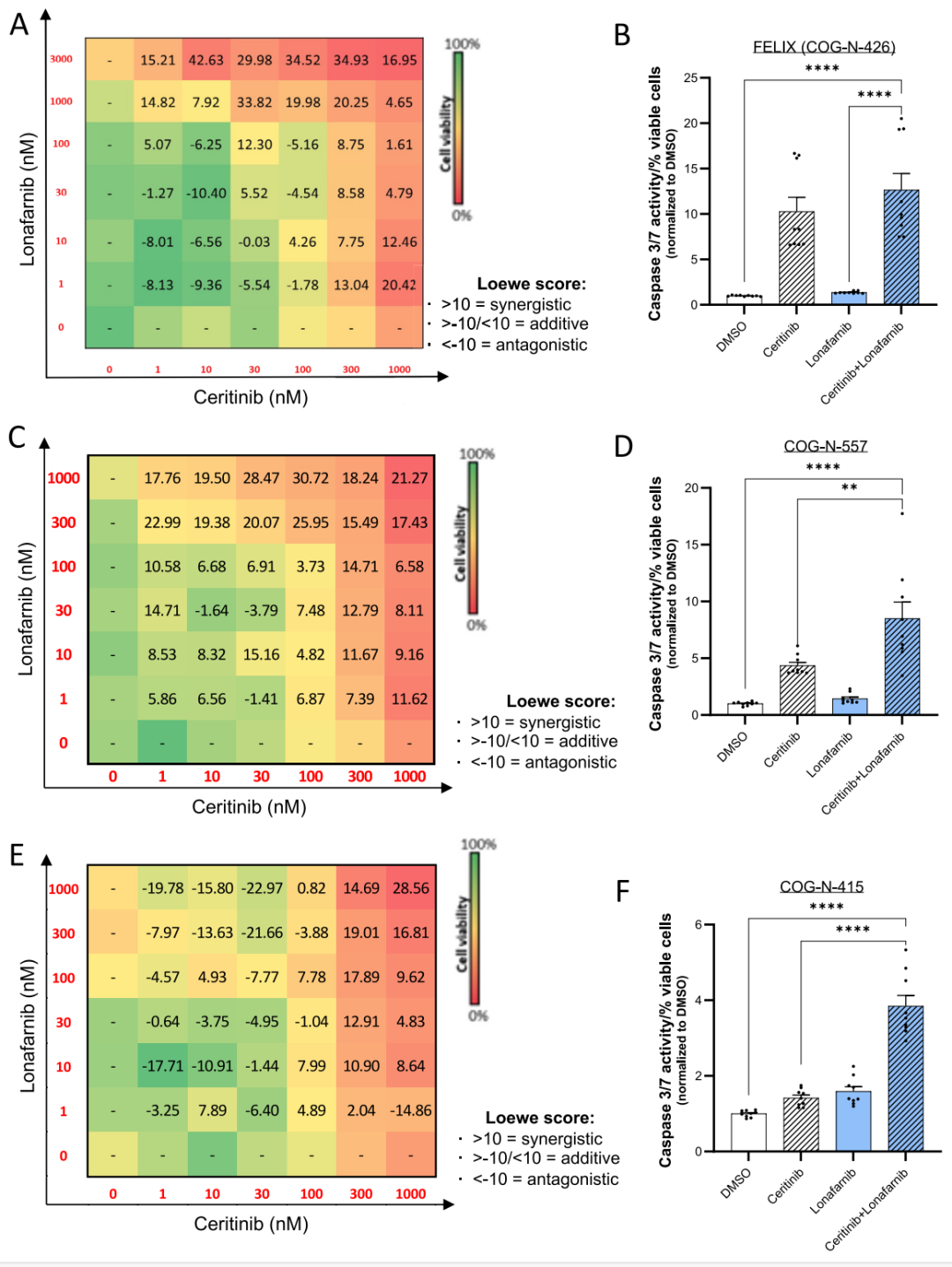
图6.ALK抑制剂和FTI在PDX细胞模型中协同诱导细胞凋亡。(A)lonafarnib和ceritinib单独或联合作用于FELIX PDX细胞72小时后的剂量-反应矩阵;(B)细胞凋亡caspase 3/7活性的定量分析柱状图;(C, E) lonafarnib和ceritini单独或联合作用于COG-N-557和COG-N-415 PDX细胞72 h后的剂量-反应矩阵。(D, F)使用lonafarnib和ceritinib或单一药物(相同剂量)联合处理72h后,COG-N-557和COG-N-415细胞凋亡caspase 3/7活性的定量分析柱状图。
最后,作者在FELIX-PDX COG-N-426x模型中验证了lorlatinib和ALK抑制剂联用的疗效。体内实验观察到与对照组相比,ceritinib或lonafarnib单药治疗能使肿瘤生长速率降低,而联合用药治疗效果最为显著,在给药期间使肿瘤发生生长停滞,其抑瘤效率显著优于单药组,并延长了生存期,值得注意的是,在整个治疗期间并未观察到毒副反应,相似的结果在COG-N-415x PDX神经母细胞瘤模型中也得到了验证。因此,该研究在体内证实了ALK TKI和FTI联合用药在治疗ALK异常的高危NB异种移植模型中具有高疗效和良好的耐受性。
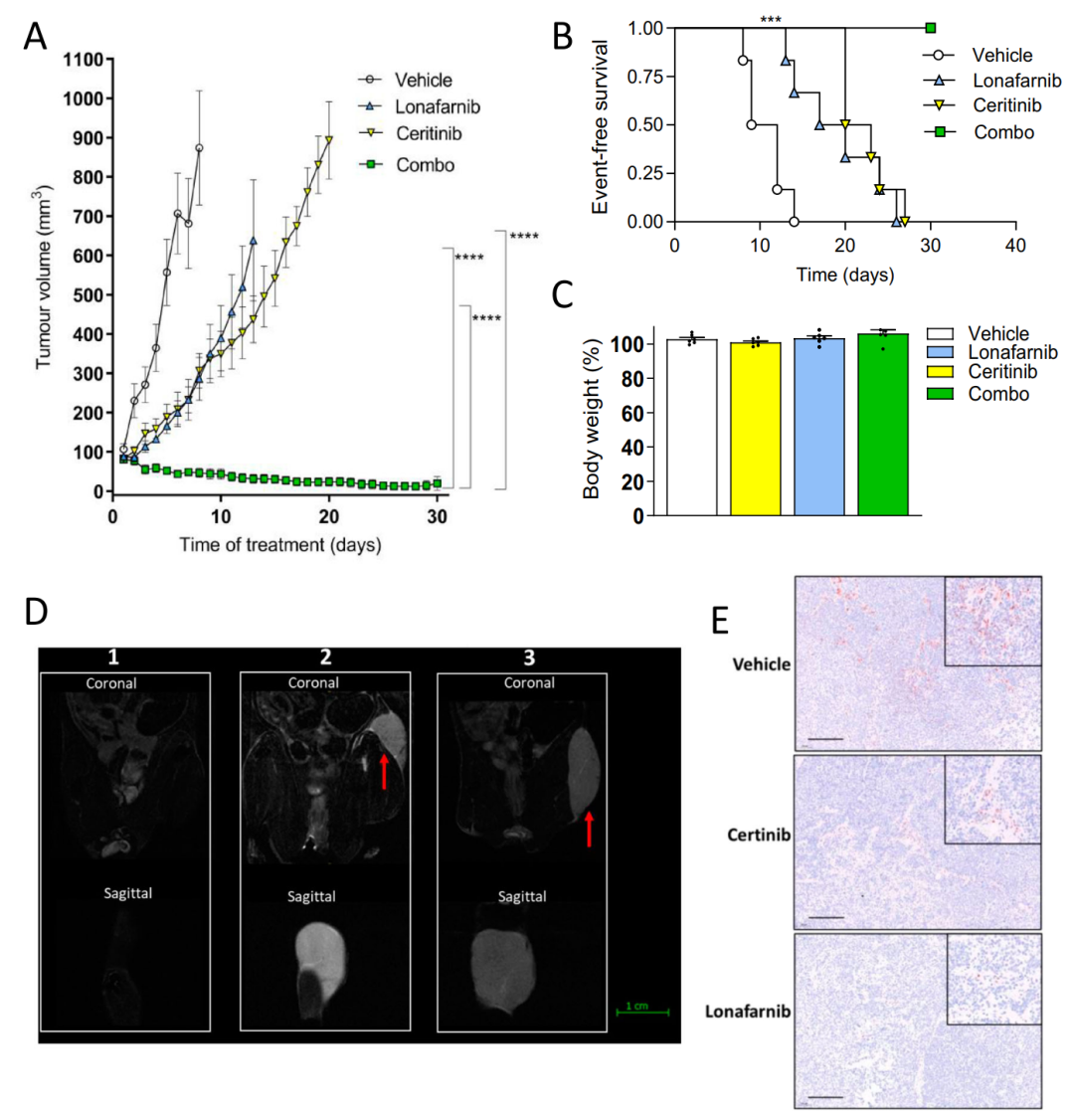
图7.ALK抑制剂(ceritinib)与FTI (lonafarnib)的联合在体内显著抑制PDX肿瘤的生长。(A)皮下注射COG-N-426x原代NB细胞的NSG小鼠的肿瘤体积随时间变化的曲线图。(B)Kaplan-Meier EFS分析。(C)实验组小鼠在实验终点相对于基线体重的体重。(D) MRI扫描的代表性图像。红色箭头提示肿瘤;(E)免疫组织化学实验检测p-ERK在小鼠肿瘤组织中的表达。
综上,该研究利用3种不同的ALK和MYCN状态的PDX模型验证了ALK TKI和lonafarnib的协同抑瘤效应。该联合用药组合的在体内的安全性良好。值得注意的是,即使在停止治疗后观察到肿瘤的复发,但治疗后观察到的缓解仍具有重要的临床意义,这项研究为治疗难治性/复发性神经母细胞瘤提供了一种新的策略,值得进一步深入探索。


