Nat Commun:南方医科大学高平/孙林冲研究揭示了瓜氨酸化调节稳定HIF-1α以促进肿瘤进展
时间:2024-09-05 14:01:02 热度:37.1℃ 作者:网络
瓜氨酸化在多种生理或病理过程中发挥着重要作用,但瓜氨酸化是否参与调节肿瘤进展及其潜在的治疗意义尚未得到很好的探讨。
2024年9月3日,南方医科大学高平、孙林冲共同通讯在Nature Communications 在线发表题为“Citrullination modulation stabilizes HIF-1α to promote tumour progression”的研究论文,该研究结果揭示了瓜氨酸化是一种与HIF-1α稳定性相关的翻译后修饰,并表明靶向PADI4介导的HIF-1α瓜氨酸化是一种有前景的治疗HIF-1α异常表达癌症的策略。
研究发现肽基精氨酸脱亚胺酶4 (PADI4)直接与R698处的低氧诱导因子1α (HIF-1α)相互作用,促进HIF-1α稳定。在机制上,PADI4介导的HIF-1α R698瓜氨酸化阻断了von Hippel-Lindau (VHL)的结合,从而对抗HIF-1α泛素化和随后的蛋白酶体降解。研究还发现瓜氨酸化HIF-1αR698、HIF-1α和PADI4在肝细胞癌(HCC)肿瘤组织中高表达,提示PADI4介导的HIF-1αR698瓜氨酸化与癌症发展之间存在潜在的相关性。此外,研究发现甲磺酸二氢麦角胺(DHE)作为PADI4的拮抗剂,最终抑制肿瘤进展。

缺氧是肿瘤微环境(TME)的标志,是癌细胞增殖增加和血管发育异常的结果。为了克服实体肿瘤中的严重缺氧应激,肿瘤内部细胞通过诱导缺氧诱导因子1 (HIF-1)表达来促进下游基因转录,从而促进各种肿瘤生物学过程,包括不受限制的细胞增殖、上皮-间质转化和免疫抑制。然而,HIF-1α除了其病理作用外,在生理条件下也发挥着关键作用,因此,单独靶向HIF-1α会对正常组织造成不必要的损伤。因此,阐明病理条件下HIF-1α活性和蛋白稳定性的调控机制,针对肿瘤进展过程中激活的HIF-1α介导的网络具有重要意义。
在常氧条件下,HIF-1α被脯氨酸羟化酶结构域蛋白1-3 (PHD -1)羟基化,其中氧是辅助因子。羟基化的HIF-1α随后被von Hippel-Lindau (VHL)蛋白(E3泛素连接酶)识别,并通过蛋白酶体途径进一步降解。在缺氧条件下,随着氧水平的降低,PHD酶活性下调,导致HIF-1α蛋白的稳定。翻译后修饰(PTMs)因其在蛋白质结构、活性和功能中的重要作用而日益得到认可。除了羟基化外,最近的研究表明HIF-1α还受到其他修饰的广泛调控,如乙酰化、磷酸化和甲基化等。有研究发现HIF-1α的SUMOylation促进了HIF-1α与VHL的结合,并在缺氧条件下作为不依赖羟化和泛素依赖性降解的信号分子。然而,HIF-1α在疾病中的翻译后调控的详细网络尚未完全阐明。
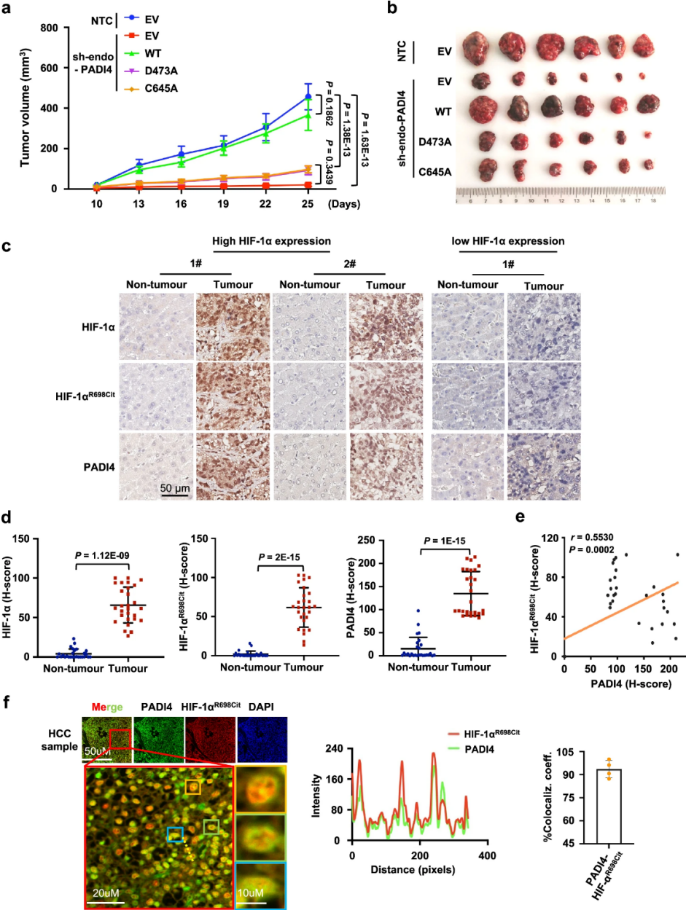
PADI4介导的HIF-1αR698瓜氨酸化促进HCC的肿瘤发生(图源自Nature Communications )
瓜氨酸化,也被称为脱亚化,是一种Ca2+依赖的PTM,它将带正电的蛋白质嵌入的精氨酸转化为电中性和未编码的氨基酸瓜氨酸,导致分子质量损失1 Da,氢键形成减少。该反应由肽精氨酸脱亚胺酶(PADs)家族催化,包括PADI1-4和PADI6。瓜氨酸化通过调节蛋白折叠和蛋白-蛋白相互作用(PPIs)参与多种生物学过程,包括早期胚胎发生、干细胞多能性、中性粒细胞胞外陷阱(NET)形成和终表皮分化。瓜氨酸化蛋白是类风湿关节炎(RA)的标志,过度活跃的瓜氨酸化已被证明与病理状况有关。有研究发现缺氧在人成纤维细胞样滑膜细胞中以HIF-1α-依赖的方式上调PADI2和瓜氨酸化蛋白,提出缺氧参与RA的机制。然而,瓜氨酸化是否参与肿瘤缺氧微环境的重塑尚不清楚,如果是这样,其潜在的分子机制和意义仍然未知。
研究揭示了肿瘤进展过程中PADI4表达促进了HIF-1α的瓜氨酸化修饰。具体来说,PADI4直接结合HIF-1α并在R698位点使其瓜氨酸化。因此,PADI4依赖性HIF-1αR698瓜氨酸化通过竞争性抑制VHL-HIF-1α结合来增强HIF-1α的稳定性和转录活性,从而促进肿瘤进展。值得注意的是,研究证明甲磺酸二氢麦角胺(DHE)破坏PADI4和HIF-1α的相互作用,通过占据PADI4负责HIF-1α瓜氨酸化的酶袋,促进HIF-1α降解并抑制肿瘤进展,为开发针对异常HIF-1α表达的癌症的治疗策略提供了基本原理。
参考消息:
https://www.nature.com/articles/s41467-024-51882-w


