【协和医学杂志】PTEN基因突变Cowden综合征相关单侧多中心乳腺癌及同时性、异时性双侧乳腺癌3例
时间:2024-09-22 22:00:19 热度:37.1℃ 作者:网络
病例资料
1.1 病例1::单侧多中心乳腺癌伴对侧多发不典型增生及叶状肿瘤
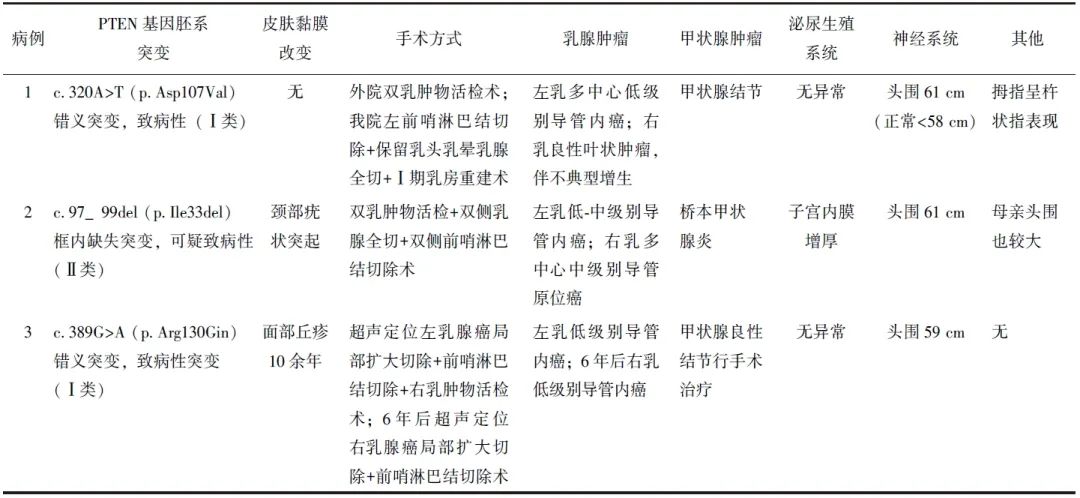
患者女性,28岁,未婚未育。2020年因“自行触及双乳肿物”于外院行双乳肿物切除活检术,术后病理示:(左乳3枚肿物)乳腺多发纤维腺瘤,周边见导管上皮不典型增生,三枚肿物均可见多灶低级别导管内癌(最大直径约7 mm);(右乳腺肿物)符合乳腺良性叶状肿瘤,伴导管上皮不典型增生。于2021年2月就诊于北京协和医院乳腺外科门诊。
查体:头围61 cm,双手拇指均为杵状指表现;双乳未触及肿物,双侧乳头无血性溢液。乳腺超声示:双乳多发实性结节,BI-RADS 3-4a类;乳腺钼靶示:左乳外上象限稍高密度结节伴簇状分布微钙化,BI-RADs 4a类。因门诊发现该患者头围明显增大,建议行基因检测,发现PTEN胚系变异:c.320A>T,为致病性(Ⅰ类)。患者既往患有甲状腺结节,无乳腺癌家族史。
因未婚未育,患者及其家属要求本次仅处理左乳病变,遂在我院乳腺外科与整形外科联合行全麻下保留皮肤及乳头乳晕的左乳腺单纯切除(NSM)术+左侧前哨淋巴结切除术+硅胶假体置入Ⅰ期乳房重建术,术后病理示:(左)乳腺多发导管内乳头状瘤、纤维腺瘤及腺瘤,伴导管上皮多灶不典型增生,可见低级别导管内癌(直径约2 mm)及低级别导管内癌累及纤维腺瘤(直径约5 mm);免疫组化结果示:雌激素受体(ER)(强阳90%),孕激素受体(PR)(强阳90%),人表皮生长因子受体2(receptor 2, HER2)(2+),Ki-67(index 5%);(左)前哨淋巴结呈慢性炎(0/1)。分期为TisN0M0,0期;术后口服托瑞米芬进行内分泌治疗,至今未复发。
1.2 病例2:双侧同时性乳腺癌(其中一侧为多中心性乳腺癌)
患者女性,37岁。2023年因“发现左乳肿物+右乳头血性溢液2个月,确诊左乳腺癌1个月”就诊于北京协和医院乳腺外科。乳腺超声示:左乳内下象限肿物,BI-RADS 5类;右乳腺体紊乱区,BI-RADS 4c类;双乳肿物空芯针穿刺活检病理示:(左乳肿物)中级别导管内癌;(右乳紊乱区)导管内乳头状瘤。
查体:头围61 cm;颈项部多发疣状突起;左乳内下可触及质硬肿物(直径约3 cm);右乳头可挤出单孔深黄色清亮溢液,其外侧可及腺体增厚区(范围约2 cm)。
既往史:14年前因“甲状腺良性结节”行甲状腺部分切除术。家族史:母亲头围也较大,无乳腺癌家族史。在我院全麻下行超声定位右乳肿物切除活检术+双侧乳腺单纯切除+双侧前哨淋巴结活检术。
术后病理示:(左)乳腺低-中级别导管内癌(大小5.0 cm×1.3 cm×0.6 cm),免疫组化结果示:ER(弱阳60%),PR(中阳80%),HER2(2+),Ki-67(index 5%);(右乳4点肿物)乳腺中级别导管原位癌(直径3 cm),导管内乳头状瘤,另见乳腺纤维腺瘤;(右乳9点肿物)乳腺中级别导管原位癌(最大范围5 cm),部分累及腺病,部分累及导管内乳头状瘤;免疫组化结果示:ER(强阳90%),PR(强阳90%),HER2(2+),Ki-67(index 3%);双侧前哨淋巴结均未见转移。双侧分期均为TisN0M0,0期;其中右侧为多中心乳腺癌。术后完善二代测序(NGS)示:PTEN基因c.97_99del(p.Ile33del),杂合突变型,可疑致病性(Ⅱ类)。术后无需辅助治疗,随访未复发。
1.3 病例3:双侧异时性乳腺癌
患者女性,28岁。2017年(患者22岁)因“体检发现左乳肿物半月余”于外院行左乳肿物活检术,术后病理示:左乳低级别导管原位癌,ER(70%+),PR(>70%+),HER2(2+),Ki-67(约5%),为行进一步手术收入北京协和医院。查体:头围59 cm,面部可见散在丘疹及粉刺,双乳未及肿物。既往史:10年前出现面部丘疹,2011年因甲状腺结节行手术治疗,无乳腺癌家族史。
2017年在我院全麻下行超声定位左乳腺癌局部扩大切除+左侧前哨淋巴结活检+右乳肿物活检术,术后病理示:(左乳瘤周组织)乳腺纤维腺瘤,导管上皮增生;各个保乳切缘均为阴性,(左)前哨淋巴结呈慢性炎(0/3);(右乳肿物)乳腺腺病,局灶纤维腺瘤形成。术后行左乳放疗+托瑞米芬口服内分泌治疗,定期复查。因患者为小于25岁的极年轻乳腺癌,故建议胚系基因突变检测;结果提示PTEN 错义突变,c.389G>A(p.Arg130Gin),杂合突变型,致病性(Ⅰ类)。
2023年(患者28岁)因发现右乳肿物于当地医院行右乳肿物微创旋切活检术,病理结果于我院会诊提示:乳腺纤维腺瘤,局灶导管上皮不典型增生;乳腺导管内乳头状瘤伴低级别导管内癌;免疫组化结果示:ER(强阳,90%),CK5/6(局灶+),P63(肌上皮+),Ki-67(index 5%)。后于我院行局麻下超声定位右乳腺癌局部扩大切除+右侧腋窝前哨淋巴结切除术。术后病理示:右乳各个保乳切缘均为阴性;(右)前哨淋巴结呈慢性炎(0/3)。术后行右乳放疗,停用托瑞米芬,将内分泌治疗升级为卵巢功能抑制+依西美坦。随访至今未复发。
3例患者多系统临床表现、手术方式及病理结果见表1。
表1 3例PTEN基因突变相关乳腺癌患者的多系统临床表现
讨论
2.1 PTEN突变与遗传性肿瘤综合征
PTEN基因定位在10号染色体长臂2区3带第3亚带(10q23.3),通过抑制PI3K/AKT/mTOR实现抑癌效应;PTEN突变导致该途径失调、细胞过度生长[1]。PTEN基因可分为N端(磷酸酶结构域)和C端(C2结构域、PDZ结构域),C2结构域突变的癌症发病率显著高于N端区域突变。研究提示,C2结构域突变中 100%(7/7)的女性和N端突变中 50% (4/8)的女性罹患乳腺癌。
此外,PTEN的无义突变、移码突变、错义突变和剪接位点突变4种变异类型之间的癌症发病率无显著差异,即PTEN突变位点可能与肿瘤发生相关,而其突变类型与患癌风险无直接相关性[2]。本文3例患者PTEN突变点均位于N端区域,其中2例为错义突变,1例为框内缺失突变。
一项纳入64项研究的荟萃分析显示,乳腺癌患者总体PTEN突变率约为3.3%;PTEN突变的健康女性罹患乳腺癌的风险约为无突变女性的3.7倍,属于乳腺癌相关中危基因[3]。PHTS是一种罕见综合征,发生率约1/20万[1];Cowden综合征是PHTS的最常见形式,是常染色体显性遗传病,其特征包括多发性错构瘤,以及乳房、皮肤、甲状腺、子宫内膜、胃肠道和中枢神经系统的恶性肿瘤及良性疾病;PHTS/Cowden综合征人群乳腺癌的终身罹患风险约为67%~85%[1]。
本文3例乳腺癌患者均携带PTEN基因Ⅰ类/Ⅱ类突变,均有甲状腺结节;其中2例有面颈部皮肤改变,1例存在子宫内膜增厚,均无胃肠道表现及乳腺癌家族史,至少符合2项主要诊断标准,均可诊断为Cowden综合征。
2.2 PHTS/Cowden综合征相关乳腺癌临床病理特征及诊治
PHTS/Cowden综合征相关乳腺癌与散发乳腺癌不同,呈现年轻化、多发性和第二原发乳腺癌风险增加等特征[1,4]。头围增大是PHTS/Cowden综合征的重要指标,指成年女性头围>58 cm,具体机制尚不清楚[1,5]。
本文3例患者均存在头围增大,巨头畸形在临床上易于识别,对PTEN突变的灵敏度、特异度分别为100%、53%;高灵敏度提示这种简单的测量方法有助于初步诊断PHTS/Cowden综合征;而详细的病史和全面的体检有助于最终确诊,弥补巨头畸形特异度与阳性预测值较低的不足[5]。此外,本文3例患者多发性错构瘤及胃肠道病变并不明显,仅有少量较轻的皮肤改变。
PHTS/Cowden综合征患者可同时出现乳腺恶性肿瘤伴多种良性疾病,并常表现为多中心、多病灶乳腺癌或双侧乳腺癌等高肿瘤负荷状态[5-7]。一项来自日本的研究提示,26例PHTS/Cowden综合征女性患者中20例患有乳腺疾病,其中16例(80%)为乳腺癌,5例(31%)为双侧乳腺癌,多数为ER和PR阳性[2],这与年轻乳腺癌患者常为ER、PR阴性的表现有所不同。PHTS/Cowden综合征患者常有双侧乳腺多发良性肿物[6-7]。本文3例患者均有双侧乳腺多发肿物,且同时存在导管内乳头状瘤、不典型增生、导管内癌等阶梯递进式的病理类型,其导管内癌不除外是在癌前病变基础上因PTEN抑癌作用缺失而出现多点恶变,故早诊早治十分重要。
PHTS/Cowden人群需对乳腺进行更早、更密切的监测。研究提示,PHTS/Cowden密切监测组中均为乳腺肿瘤直径>2 cm且无腋窝淋巴结转移(T1N0)的早期病例,而未行强化监测组中的60%乳腺肿瘤直径>2 cm,为T2及以上分期,45%伴有腋窝淋巴结转移[8]。
美国国家综合癌症网络(NCCN)指南建议PHTS/Cowden综合征人群从25岁或家族中最早已知乳腺癌发生前 5~10岁起(以先到者为准),每 6~12个月进行1次临床乳腺检查;从30岁或家族中最早已知乳腺癌发生前10岁起(以先到者为准),每年进行1次乳腺钼靶检查和乳腺 MRI 筛查[9]。
欧洲遗传肿瘤综合征网络发布的PHTS女性乳腺癌监测指南建议从30岁起每年行乳腺MRI检查(推荐强度:强推荐),从40岁起每2年进行1次乳腺钼靶检查(推荐强度:中等推荐)[10]。乳腺MRI的高灵敏度可增加25岁以上高危女性的早期乳腺癌检出率[8];而超声作为我国女性乳腺癌筛查最敏感有效的首选影像学检查,具有准确性高、无辐射、操作简便、可移动等优势[11-12],可用于PHTS/Cowden人群更早、更频繁的乳腺检查。
与BRCA1/2胚系突变类似,PHTS/Cowden人群中有很高的乳腺癌终身发病风险,理论上预防性切除可能为部分患者带来获益[8,13-14],但仍需更多证据。目前PTEN基因突变尚不足以作为双侧或对侧预防性切除指征,预防性切除手术的决策需要结合患者家族史进行多学科会诊,充分讨论个体化获益。此外,年轻PHTS/Cowden综合征相关乳腺癌患者通常存在生育或化疗前生殖力保护的需求;鉴于该病为常染色体显性遗传,故考虑后代携带PTEN基因突变及罹患该病的风险非常重要;建议遗传学咨询和生殖专家共同参与多学科讨论以制订合理的诊疗与生育方案[15-16]。
对于PHTS/Cowden综合征患者,除严密监测乳腺病变情况外,还需对甲状腺、肾脏、消化道、皮肤等多器官/系统进行监测[10]。例如,推荐18岁以上患者每年进行甲状腺超声检查(推荐强度:强推荐),推荐40岁以上患者每两年进行肾脏超声检查(推荐强度:中等推荐),推荐35岁以上患者定期进行结肠镜、皮肤系统检查(推荐强度:弱-中等推荐)等。
综上,PHTS/Cowden综合征是多系统受累的罕见疾病,会导致乳腺癌等多种肿瘤患病风险增加,对于此类患者,早诊早治至关重要,对患有乳腺多发良恶性疾病伴巨头畸形的患者应进行皮肤、口腔、甲状腺、胃肠道等多系统检查,并开展遗传咨询及多学科协作的个体化管理。
注:本研究已通过北京协和医院伦理委员会审批(审批号:K464)
参考文献
[1]Yehia L, Keel E, Eng C.The clinical spectrum of PTEN mutations[J]. Annu Rev Med, 2020, 71: 103-116.
[2]Teramae S, Muguruma N, Okamoto K, et al. Cancer risk and genotype-phenotype correlation in Japanese patients with Cowden syndrome[J]. Int J Clin Oncol, 2022, 27(4): 639-647.
[3]Yari K, Hakimi A, Mohammadi M, et al. The association of PTEN gene mutations with the breast cancer risk: a systematic review and meta-analysis[J]. Biochem Genet, 2024, 62(3): 1617-1635.
[4]Brewer T, Yehia L, Bazeley P, et al. Exome sequencing reveals a distinct somatic genomic landscape in breast cancer from women with germline PTEN variants[J]. Am J Hum Genet, 2022, 109(8): 1520-1533.
[5]Shiovitz S, Everett J, Huang S C, et al. Head circumference in the clinical detection of PTEN hamartoma tumor syndrome in a clinic population at high-risk of breast cancer[J]. Breast Cancer Res Treat, 2010, 124(2): 459-465.
[6]Gómez García E B, Lobbes M B I, Van De Vijver K, et al. Occult breast cancer due to multiple calcified hamartomas in a patient with Cowden syndrome[J]. Case Rep Radiol, 2012, 2012: 638725.
[7]Im C J, Miller A, Balassanian R, et al. Early onset, multiple, bilateral fibroadenomas of the breast: a case report[J]. BMC Womens Health, 2021, 21(1): 170.
[8]Hoxhaj A, Drissen M M C M, Vos J R, et al. The yield and effectiveness of breast cancer surveillance in women with PTEN Hamartoma Tumor Syndrome[J]. Cancer, 2022, 128(15): 2883-2891.
[9]NCCN Guidelines genetic/familial high-risk assessment: breast, ovarian, and pancreatic[Z]. 2023.
[10]Tischkowitz M, Colas C, Pouwels S, et al. Cancer surveillance guideline for individuals with PTEN hamartoma tumour syndrome[J]. Eur J Hum Genet, 2020, 28(10): 1387-1393.
[11]Shen S, Zhou Y, Xu Y, et al. A multi-centre randomised trial comparing ultrasound vs mammography for screening breast cancer in high-risk Chinese women[J]. Br J Cancer, 2015, 112(6): 998-1004.
[12]Wang Y J, Li Y C, Song Y, et al. Comparison of ultrasound and mammography for early diagnosis of breast cancer among Chinese women with suspected breast lesions: a prospective trial[J]. Thorac Cancer, 2022, 13(22): 3145-3151.
[13]Ngeow J, Stanuch K, Mester J L, et al. Second malignant neoplasms in patients with Cowden syndrome with underlying germline PTEN mutations[J]. J Clin Oncol, 2014, 32(17): 1818-1824.
[14]Ali E, Athanasopoulos P G, Forouhi P, et al. Cowden syndrome and reconstructive breast surgery: case reports and review of the literature[J]. J Plast Reconstr Aesthet Surg, 2011, 64(4): 545-549.
[15]Kalin A, Merideth M A, Regier D S, et al. Management of reproductive health in Cowden syndrome complicated by endometrial polyps and breast cancer[J]. Obstet Gynecol, 2013, 121(2 Pt 2 Suppl 1): 461-464.
[16]Winter H, McEwen A. Cowden syndrome: presenting as advanced breast cancer in a young woman with macrocephaly[J]. Intern Med J, 2012, 42(10): 1160-1161.


