EGFR-TKI耐药后小细胞肺癌转化如何应对?免疫联合化疗和DLL3靶向药物值得关注
时间:2024-11-10 17:00:16 热度:37.1℃ 作者:网络
小细胞转化(SCT)是对第三代表皮生长因子受体抑制剂(EGFRi)产生适应性耐药的典型机制,EGFRi 已成为 EGFR 驱动的非小细胞肺癌(EGFR+ NSCLC)的标准治疗。关于 SCT 患者的最佳管理知之甚少。本研究旨在比较单独使用铂类/依托泊苷化疗(化疗)或联合 EGFR 抑制剂(EGFRi+化疗)或免疫检查点抑制剂(ICI+化疗)的结果。此外,探索了 DLL3 表达作为潜在的新治疗靶点。对在欧洲和美国 19 个中心治疗的发生 SCT 的 EGFR+ NSCLC 患者进行了回顾性研究。共纳入 47 例患者,其中 17 例接受化疗,20 例接受 ICI+化疗,10 例接受 EGFRi+化疗。通过免疫组化分析 DLL3 表达。在整个队列中,从第一种 SCT 治疗开始的中位总生存期(OS)为 11 个月(95% 置信区间 [95% CI] 9.1-12.9),中位无进展生存期(PFS)为 5 个月(95% CI 4.2-5.8)。所有三组(化疗和 ICI+化疗 4 个月,EGFRi+化疗 6 个月)的中位 PFS 相似,ICI+化疗组、EGFRi+化疗组和化疗组的 12 个月 PFS 率分别为 12%(95% CI 2%-31%)、13%(95% CI 0%-43%)和 0%。ICI+化疗组的中位 OS 为 13 个月(95% CI 5.5-20.5),而化疗组(95% CI 7.6-12.4)和 EGFRi+化疗组(95% CI 8.1-11.9)为 10 个月。SCT 前后分别有 0% 和 93% 的肿瘤为 DLL3 阳性。本研究结果表明,ICI+化疗和 DLL3 靶向药物值得在发生 SCT 的 EGFR+ NSCLC 中进一步探索。
研究背景
小细胞转化(SCT)是先前诊断为非小细胞癌的患者发生小细胞神经内分泌癌的组织病理学诊断。在第一代和第二代 EGFR 酪氨酸激酶抑制剂(EGFRi)治疗后进展的携带表皮生长因子受体激活突变(EGFR+ NSCLC)的非小细胞肺癌患者中,约 3% 描述了 SCT。对于第三代 EGFRi,如奥希替尼,这种耐药机制的发生率增加到 15%-23%。在临床实践中,考虑到组织再活检的要求,SCT 可能诊断不足,但鉴于第三代 EGFRi 在转移性和辅助治疗中的使用越来越多,预计 SCT 诊断率会上升。
发生 SCT 的 EGFR+ 肺癌的最佳治疗证据很少。铂类和依托泊苷化疗用于治疗新发 SCLC,拥有最广泛的数据库,被许多专家认为是当前标准治疗。在该基础上添加免疫检查点抑制剂(ICI)提高新发 SCLC 的总生存率,但在小细胞转化的 EGFR+ 肺癌中,情况不太清楚。ICI 单药或联合化疗在未经选择的 EGFRi 治疗后进展的 EGFR+ NSCLC 患者中缺乏疗效,引发了对 SCLC 样免疫+化疗方案在这种情况下的适用性的怀疑。
本研究描述了铂类化疗单独或联合 ICI 或 EGFRi 在 47 例 SCT EGFR+ NSCLC患者的多中心队列中的临床疗效。此外,我们还提供关于突变状态和免疫表型的数据,包括 delta 样配体 3(DLL3)表达,DLL3 是一种基于 T 细胞结合抗体的新发 SCLC 的新有效治疗策略的生物标志物。
研究结果
患者特征
本分析包括 47 例 EGFR+ NSCLC 成人患者的数据,这些患者组织学证实 SCT,作为既往 EGFRi 治疗的耐药机制。奥希替尼是最常用的 TKI(63%),其次是第二代(28%)和第一代(9%)抑制剂。除了 3 例患者在手术切除后奥希替尼辅助治疗下发生 SCT,其他所有患者均接受 EGFRi 作为一线姑息治疗。在这 44 例患者中,中位 SCT 时间为 19 个月(四分位距,IQR:13 至 27 个月)。
所有患者都接受基于铂类/依托泊苷的方案作为 SCT 后一线治疗(有关 SCT 前后使用的治疗方案的详细信息见图1)。
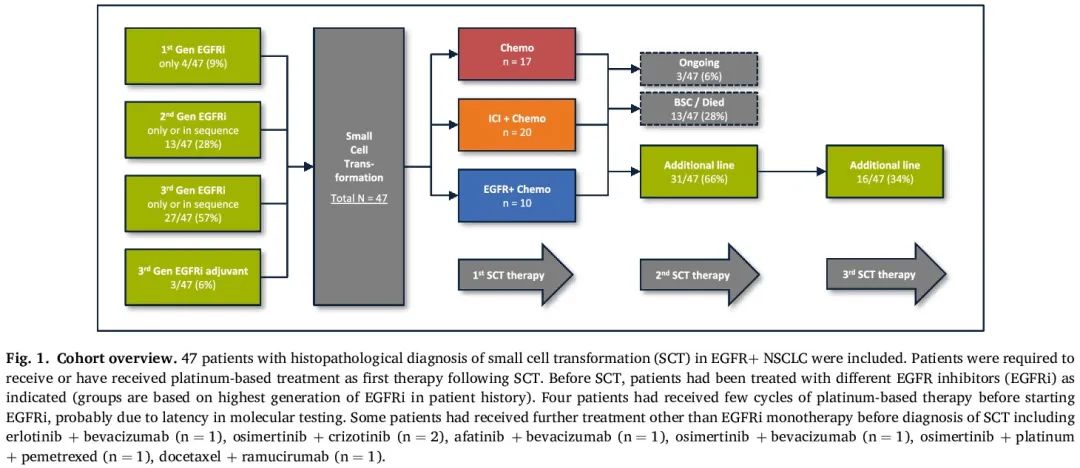
图1
晚期 NSCLC 初始诊断时的中位年龄为 61 岁,62% 为女性(表1)。40% 的患者在 NSCLC 初始诊断时、47% 的患者在 SCT 时、72% 的患者在整个观察过程中存在脑转移。值得注意的是,54% 的患者有吸烟史,其中 20% 是积极吸烟者。

表1
基线EGFR突变的分布与未经选择的欧洲/北美NSCLC队列一致(外显子19缺失63%,p.L858R 30%,罕见和复合突变8%)。大多数患者(21/31;68%)在诊断时携带 TP53 共突变(表1)。所有三个治疗亚组的患者特征基本相似。
使用 SCT 时采集的组织进行神经内分泌标志物表达检测。中位 Ki67 指数为 80%,符合真正的 SCLC 表型(表1)。在 89%(33/37)的活检样本中,初始 EGFR 突变在 SCT 后持续存在。3 例患者既往接受阿法替尼治疗,T790M 驱动耐药后接受奥希替尼治疗,在奥希替尼治疗下发生 SCT。T790M 和初始 EGFR 突变在 SCT 时仍然存在。
临床结局
所有患者均接受铂类/依托泊苷类化疗,单独(化疗;n = 17;36%)或联合抗 PD-1/PD-L1 抗体(ICI+化疗;n = 20;43%)或 EGFR 抑制剂(EGFRi+化疗;n = 10;21%)。化疗周期的中位数为 4(范围:2 至 6 个周期)。
37 例可评估患者中有 16 例(43%)对 SCT 后一线治疗有反应。化疗组和 ICI+化疗组的 ORR 分别为 46.7%(95% CI:21.3 - 73.4;n = 15)和 35.3%(95% CI:14.2 - 61.7;n = 17)。在 EGFRi+化疗组的 5 例可评估患者中,有 3 例获得客观缓解(图3)。
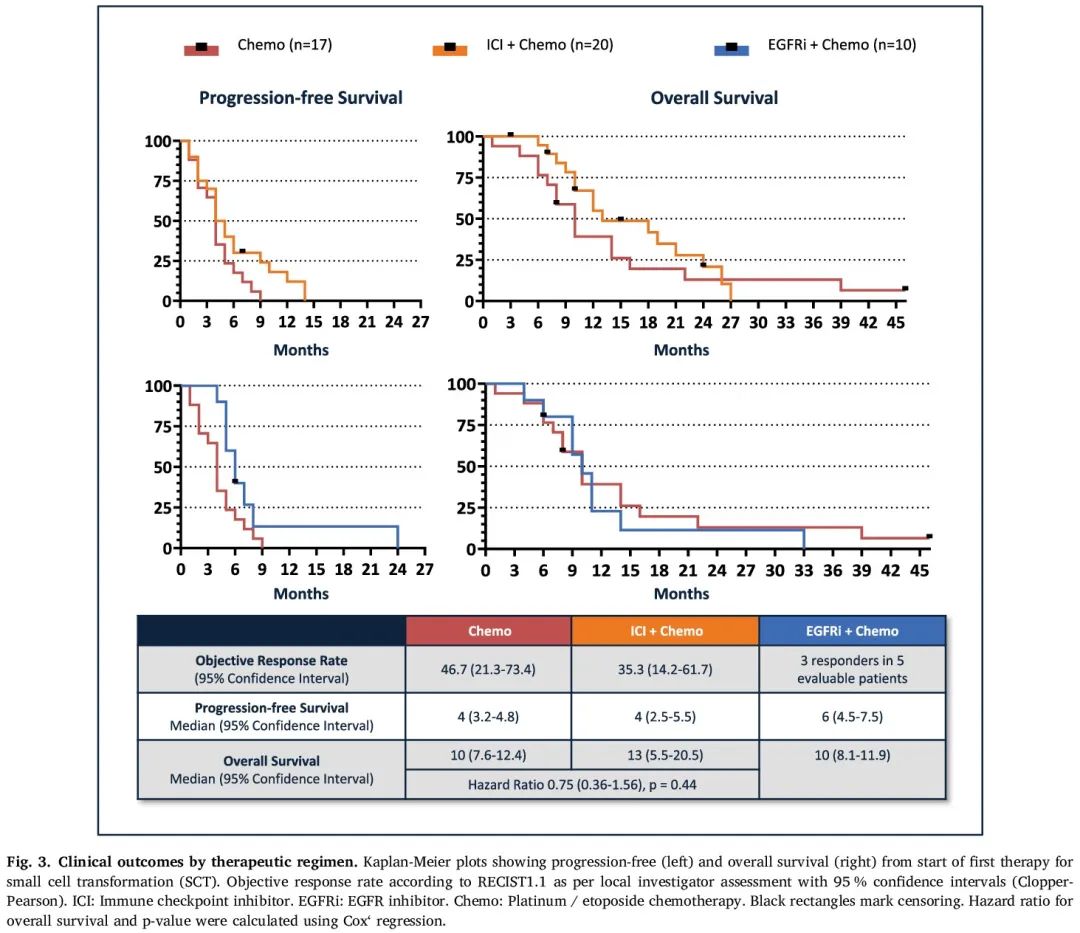
图3
在记录 96% 的 PFS 事件后,整个队列的中位 PFS 为 5 个月(95% CI:4.2-5.8)。在发生 83% 的 OS 事件后,中位 OS 为 11 个月(95% CI:9.1-12.9)(图2)。所有三个亚组的中位 PFS 相似,化疗组为 4 个月(95% CI:3.2 - 4.8),ICI+化疗组为 4 个月(95% CI:2.5 - 5.5),EGFRi+化疗组为 6 个月(95% CI:4.5-7.5)。化疗组 1 年后的 PFS 率为 0%,ICI+化疗组为 12%(95% CI 2%−31%),EGFRi+化疗组为 13%(95% CI 0%−43%)。ICI+化疗组的中位 OS在数值上最长,为 13 个月(95% CI:5.5 - 20.5)。化疗组和 EGFRi+化疗组的中位 OS 相似(10 个月,95% CI:7.6 - 12.4 和 10 个月,95% CI:8.1-11.9)。化疗组的 1 年 OS 率为 39%(95% CI 16%−61%),ICI+化疗组为 55%(95% CI 20%−75%),EGFRi+化疗组为 23%(95% CI:4%−52%)。OS 风险比显示 ICI+化疗优于化疗(0.75,95% CI:0.36–1.56,p = 0.44)和 EGFRi+化疗(0.65,95% CI:0.27–1.57,p = 0.34)的不显著趋势。
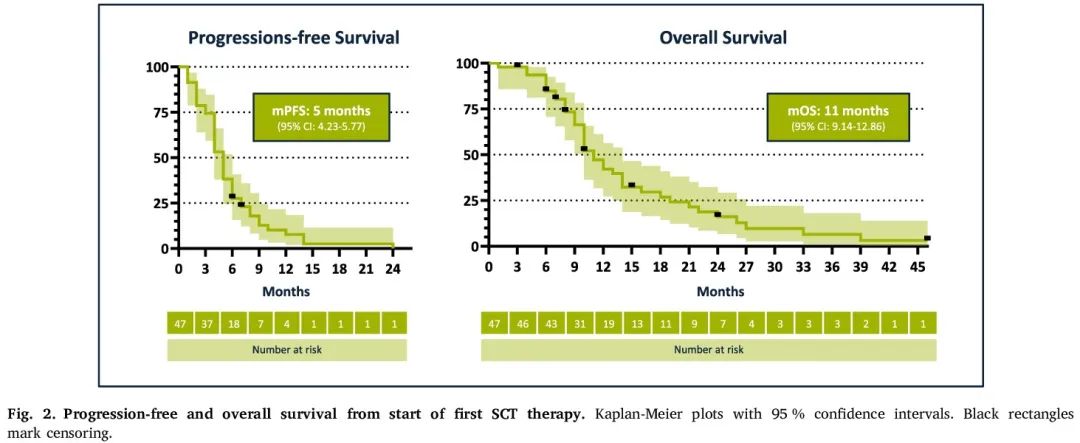
图2
单变量和多变量 Cox 回归分析均未显示治疗或其他已知危险因素(包括年龄、性别、脑转移的存在、EGFR 突变亚型和 ECOG 体能状态)与总生存期的统计学显著相关性。最强但无统计学意义的趋势是 ≤65 岁的患者的生存期长于 65 岁以上的患者(HR 0.63,95% CI 0.33-1.20,p = 0.16)。
疾病进展后的治疗
在数据截止时,大多数患者在铂类联合治疗后至少接受了一种额外的治疗(66%,31/47),6% 继续接受第一种 SCT 后方案(3/47),28% 已经死亡或正在接受最佳支持治疗(13/47)(图 1)。停止第一种 SCT 后治疗的原因包括疾病进展(91%,40/44)、毒性(5%,2/44)或患者选择(5%,2/44)。
铂类治疗失败后的治疗策略是异质性的,包括典型的 SCLC 方案,如基于拓扑替康和蒽环类药物的联合疗法(多柔比星/环磷酰胺/长春新碱),紫杉烷类药物,以及再次使用铂类或 EGFR 抑制剂。观察到偶尔的反应,但通常持续时间较短(表 2),除了化疗组中 2 例患者在对第一种 SCT 疗法分别取得 1 年和 2 年的深度缓解后再次使用含铂联合方案,包括 ICI+铂类联合方案。
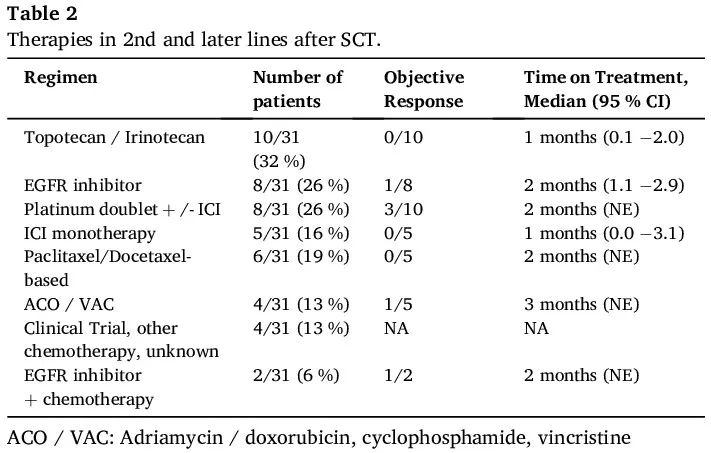
表2
DLL3表达
使用免疫组化分析了 SCT 前后活检样本的 DLL3 表达。没有一个 SCT 前样本表达 DLL3,而超过 90% 的 SCT 后样本染色呈阳性(图 4)。
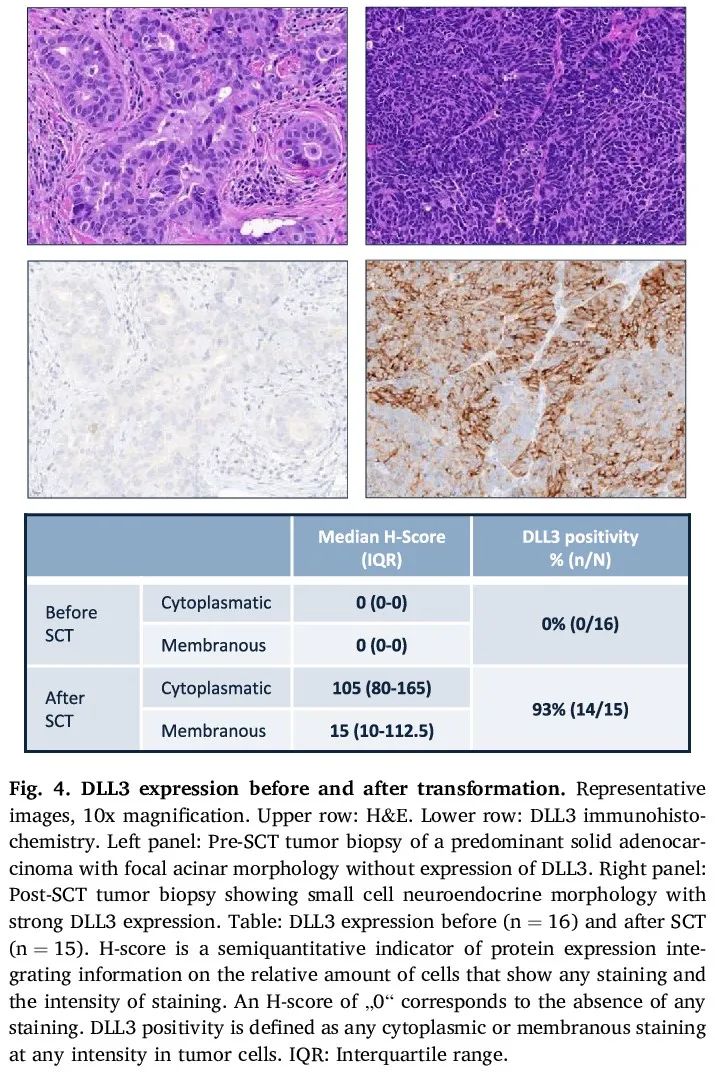
图4
讨 论
小细胞转化最初被描述为一种罕见的耐药机制,发生在约 3% 的接受第一代和第二代 EGFRi 的 EGFR+ 患者中。然而,随着第三代 EGFRi 奥希替尼的广泛应用,SCT 的发生率似乎增高。关于 EGFR+ 肺癌 SCT 后最佳管理的证据仅限于病例报告和几项队列研究,以一代 EGFRi 治疗后进展的患者为主。本研究描述了一个较新的以白种人为主的多中心队列,其中大多数患者接受了当前标准治疗奥希替尼治疗。他们的 SCT 后一线治疗是铂类/依托泊苷单独或与 EGFRi 或 ICI 联合使用。在我们 47 例患者队列中观察到的 ORR 为 43%,中位 PFS 为 5 个月,与之前发表的结果相似。此外,在整个队列中观察到的中位 OS 为 11 个月,与既往研究报告的 EGFR+ 肺癌 SCT 后的中位 OS 为 9 至 12.6 个月相比,没有太大改善。总体而言,这强调了 SCT 对预后的不良影响,其他 EGFRi 耐药机制的中位 OS 为 15 至 16 个月。
鉴于我们的数据包含大量在过去五年内接受治疗的患者,因此有助于了解改善当前 EGFR+ 肺癌 SCT 后标准治疗的潜在方法。首先,我们纳入 10 接受铂类/依托泊苷联合 EGFRi 治疗的患者,发现与仅化疗相比,PFS 在数值上更长,这与中国单中心数据一致。然而,鉴于样本量小,数值差异可能是偶然发生的,需要更多的样本进行验证。一般来说,这种治疗策略似乎是合理的,因为在我们大多数患者中,初始 EGFR 突变在 SCT 时仍然存在,既往研究显示其他队列也是如此。此外,同时靶向初始 EGFR 突变和耐药机制的联合策略已被证明对奥希替尼进展时 MET 高水平扩增的患者有益。然而,实验数据表明,小细胞转化的 EGFR+ 肺癌倾向于下调 EGFR 表达,这可能是我们 EGFRi+化疗组缺乏长期获益的原因。
SCLC 样免疫+化疗方案是 SCT EGFR+ 肺癌的另一种选择,但证据相当有限。最近,一项中国单中心研究表明,与常规化疗相比,免疫+化疗可能延长 OS(中位 OS:20 个月 vs 8 个月,风险比 0.30,95% CI:0.16 – 0.58)。然而,该研究仅包括 11 例患者,其中 9 例接受了阿替利珠单抗、贝伐珠单抗、卡铂和紫杉醇治疗,只有 2 例接受了 SCLC 中常用的卡铂、依托泊苷和阿替利珠单抗联合治疗。此外,该研究缺乏有关所应用的常规化疗方案的详细信息,因此难以评估检查点抑制剂在该队列中的真正附加值。相比之下,我们队列中所有患者接受了中位 4 个周期的铂类-依托泊苷治疗,单独或与度伐利尤单抗或阿替利珠单抗联合使用。在 ICI+化疗组中观察到的中位 OS 为 13 个月,长于单独化疗(HR 0.75,95% CI:0.36–1.56)。考虑到我们的样本量,这可能是一个随机观察结果(p = 0.44)。尽管如此,我们的数据类似于 ICI+化疗用于新发 SCLC 的关键试验(CASPIAN 和 IMpower133),在这些试验中,OS 显著延长(相比对照组的 10 个月中位延长 2-3 个月,HR 0.7)。与 CASPIAN 和 IMpower133 类似,我们在前 4 至 6 个月观察到 ICI+化疗和化疗的 PFS 曲线平行,分离较晚。鉴于此背景,在化疗中加入 ICI 似乎有可能延长 EGFR+ NSCLC SCT 后 OS,但需要更大规模的队列和/或前瞻性试验来证实这一发现。
我们的大多数 SCT EGFR+ 肺癌患者在初始诊断时携带 TP53 失活突变,这与之前的报道一致。TP53 和 RB1 双等位基因失活已被描述为 SCLC 和小细胞转化的 NSCLC 的标志。在大多数广泛期 SCLC 患者中,这种突变特征与神经内分泌转录程序有关,包括非典型 Notch 配体 DLL3 的表达。在既往接受过多线治疗的 SCLC 和其他神经内分泌癌中,使用靶向 DLL3 的双特异性 T 细胞结合抗体,ORR 为 26-40%。基于这些结果,tarlatamab(塔拉妥单抗)最近获得 FDA 批准用于经治 SCLC。在我们的队列中,DLL3 表达之前不存在,而在 SCT 后存在于绝大多数患者中,提示 DLL3 靶向药物是这种情况下的另一种潜在治疗选择。
本研究受到其回顾性和每个治疗亚组患者数量有限的限制,无法就 ICI 或 EGFRi 联合标准铂类/依托泊苷化疗的影响得出确切结论。此外,我们缺乏关于 SCT 前后患者分子和转录特征的全面数据。
在铂类/依托泊苷中加入 ICI 和/或 DLL3 靶向药物可能是解决SCT EGFR+ 肺癌不良预后的一种选择,值得在前瞻性试验中进一步研究。
参考文献:
Felix Carl Saalfeld, Johanna Möller, Petros Christopoulos, Carina Wenzel, Anna Rasokat, Xuejun Alice Wang, Ioannis Vathiotis, David König, Oliver Illini, Christian Grohé, Marcel Wiesweg, Claas Wesseler, Christoph Schubart, Natalie Pelusi, Gernot Rohde, Tobias R. Overbeck, Jutta Kirfel, Jürgen Alt, Diego Kauffmann-Guerrero, Frank Griesinger, Jonas Kulhavy, Michael Allgäuer, Anna Klimova, Maret Schütz, Daniela E. Aust, Maximilian J. Hochmair, Sacha I. Rothschild, Konstantinos N. Syrigos, Rajwanth Veluswamy, Sebastian Michels, Albrecht Stenzinger, Korinna Jöhrens, Martin Wermke, Small cell transformation in EGFR-mutated non-small cell lung cancer: DLL3 expression and efficacy of immune checkpoint inhibitors or tyrosine kinase inhibitors combined with chemotherapy, European Journal of Cancer, Volume 213, 2024, 115065, ISSN 0959-8049, https://doi.org/10.1016/j.ejca.2024.115065.



