惊!三七皂苷如何神奇逆转慢性失眠引发的大脑损伤?湖北中医大学揭秘!
时间:2024-11-11 11:01:07 热度:37.1℃ 作者:网络
睡眠剥夺(CSD)是由于工作或生活压力而遭受一定程度的CSD现象,该现象在睡眠障碍患者中尤为常见,是全球性的健康问题。研究证实,睡眠剥夺会对认知功能的多个方面产生负面影响,包括记忆力、注意力及警觉性,进而可能诱发多种神经退行性疾病,如阿尔茨海默病和帕金森病等。目前,认知行为疗法被认为是治疗失眠的首选方法,但由于其高昂的成本和需要较长时间的咨询,导致其在临床应用中面临困难。
三七总皂苷(PNS)是一种具有多种生物学活性中药成分,包括但不限于对心肌缺血的改善、学习记忆能力的提升、血脂水平的降低以及免疫系统的调节作用。尽管如此,其对中枢神经系统(CNS)的保护机制尚未得到充分的阐明。
近期,一篇题为“Mechanism of Panax notoginseng saponins in improving cognitive impairment induced by chronic sleep deprivation based on the integrative analysis of serum metabolomics and network pharmacology”的文章深入探讨了PNS治疗在缓解CSD诱导的认知功能障碍方面的机制,为PNS的临床应用奠定了理论基础。

图1 论文首页
PNS改善CSD诱导的认知功能障碍和海马神经元损伤
研究在经过15天的PNS灌胃处理后,进行了水迷宫试验。结果显示,在第五及第六天的测试中,所有研究组的大鼠逃避潜伏期均有所降低。特别是在第五天,PNS给药组的潜伏期显著低于模型组大鼠(图2B)。第六天的测试显示,模型组大鼠穿越目标区域的时间较空白组显著减少,然而PNS组则需要更长时间(图2C)。在测试当天,与空白组相比,模型组大鼠穿越平台的次数大幅下降,而PNS组则能增加这一次数(图2D)。图2E展示了空间探索试验和导航试验中大鼠的游泳轨迹。结果表明,PNS能够缓解SD大鼠认知能力的下降,且PNS-H(高剂量)组相较于PNS-L(低剂量)组效果更为显著。
各组大鼠海马及CA1区的HE染色结果显示(图2F),空白组大鼠的神经元分布均匀,形态正常,排列紧密。相比之下,模型组大鼠的神经元出现萎缩、空泡化和缺失,组织结构松散,细胞轮廓形状发生改变。模型组大鼠的神经元细胞核受损或缺失。经过PNS治疗后,这些病理变化得到了明显改善。
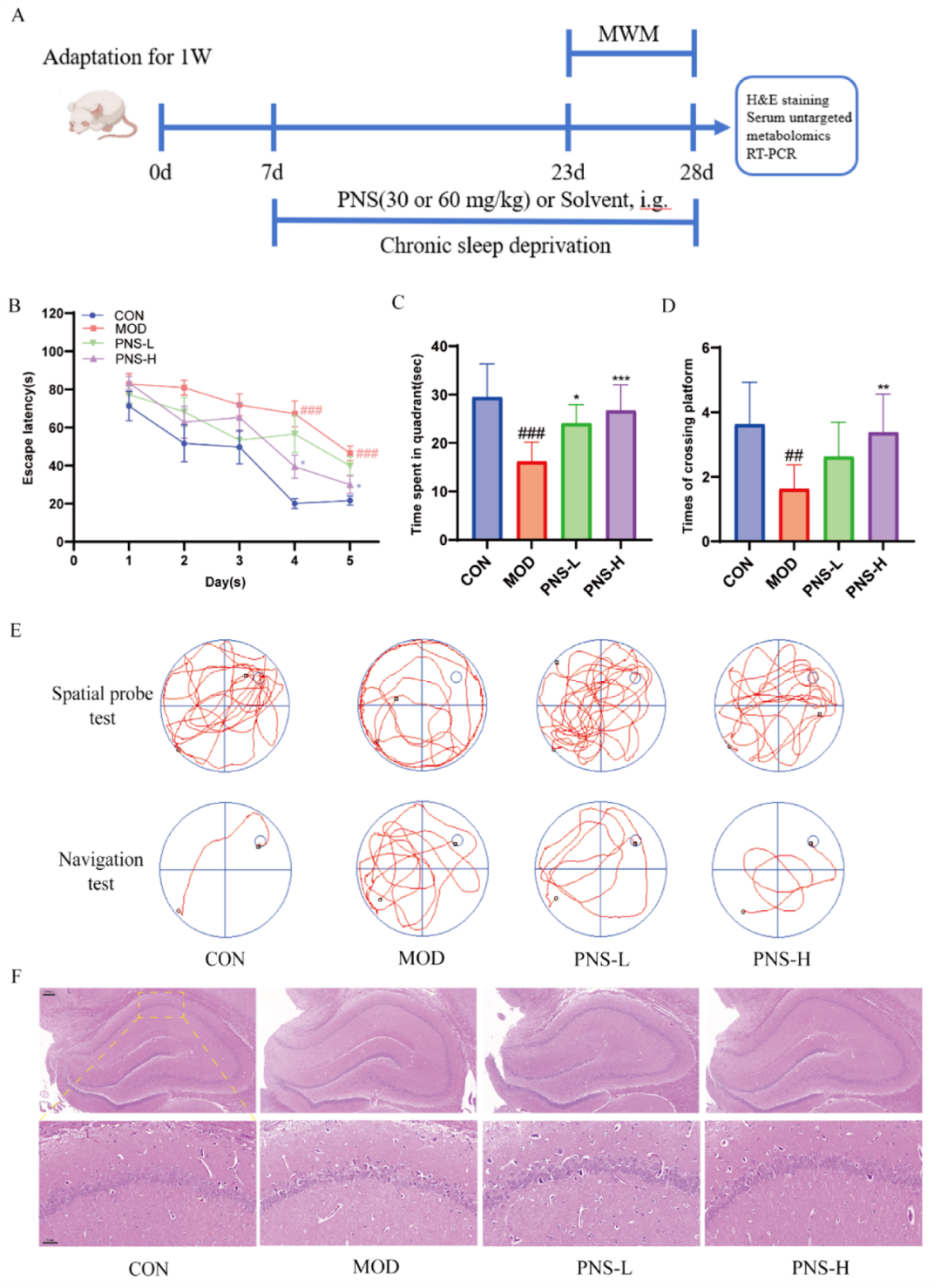
图2 PNS改善了CSD引起的学习记忆容量和海马神经元损伤
代谢组学多元数据分析
药理学研究表明CSD模型构建成功,并且PNS-L和PNS-H组在治疗由CSD引起的认知障碍方面显示出显著效果。研究采用血清非靶向代谢组学技术,探究了PNS对CSD大鼠代谢调节的影响。与对照组相比,模型组表现出4110种差异代谢物(上调2171种,下调1939种),而与模型组相比,PNS-H组则表现出4033种差异代谢物(上调2018种,下调2015种)(图3A-B)。主成分分析结果(图3C)表明,质控样品的分组清晰,验证了分析方法的稳定性和可靠性。同时,对照组与模型组之间显示出明显的分离趋势,这表明两组间血清代谢物存在显著差异。PNS-L组和PNS-H组介于对照组与模型组之间,其中PNS-H组与对照组的聚集更为紧密,这暗示PNS可能缓解由SD引起的代谢异常,并呈现出剂量依赖性趋势。基础监督判别分析PLS-DA的结果(R2Y=0.982,Q2=0.837)与PCA分析结果相一致(图3D)。在PLS-DA模型上执行的999次置换检验中,回归线R2和Q2的预期值分别为0.915和-0.171,均低于实际模型的预测值,这表明模型未出现过拟合现象(图3G)。
为进一步探索PNS-H组中具有显著治疗效果的样本,研究选取了这些样本进行深入分析,以识别相关的生物标志物。OPLS-DA分析结果(图3E-F)显示,对照组与模型组之间以及模型组与PNS-H组之间的血清代谢谱存在显著差异,R2Y和Q2值均大于0.9。具体而言,对照组与模型组之间的R2Y值为0.998,Q2值为0.990;模型组与PNS-H组之间的R2Y值为0.998,Q2值为0.986,这表明所开发的OPLS-DA模型具有强大的预测能力。对OPLS-DA模型进行的999次置换检验结果表明,对照组与模型组的回归线R2和Q2预测值分别为0.854和-0.311(图3H),模型组与PNS-H组的预测值为0.870和-0.283(图3I),均低于实际模型的预测值,进一步证明模型未出现过拟合。在该研究中,被确定为潜在生物标志物的是VIP值大于1且t检验p值小于0.05的代谢物。
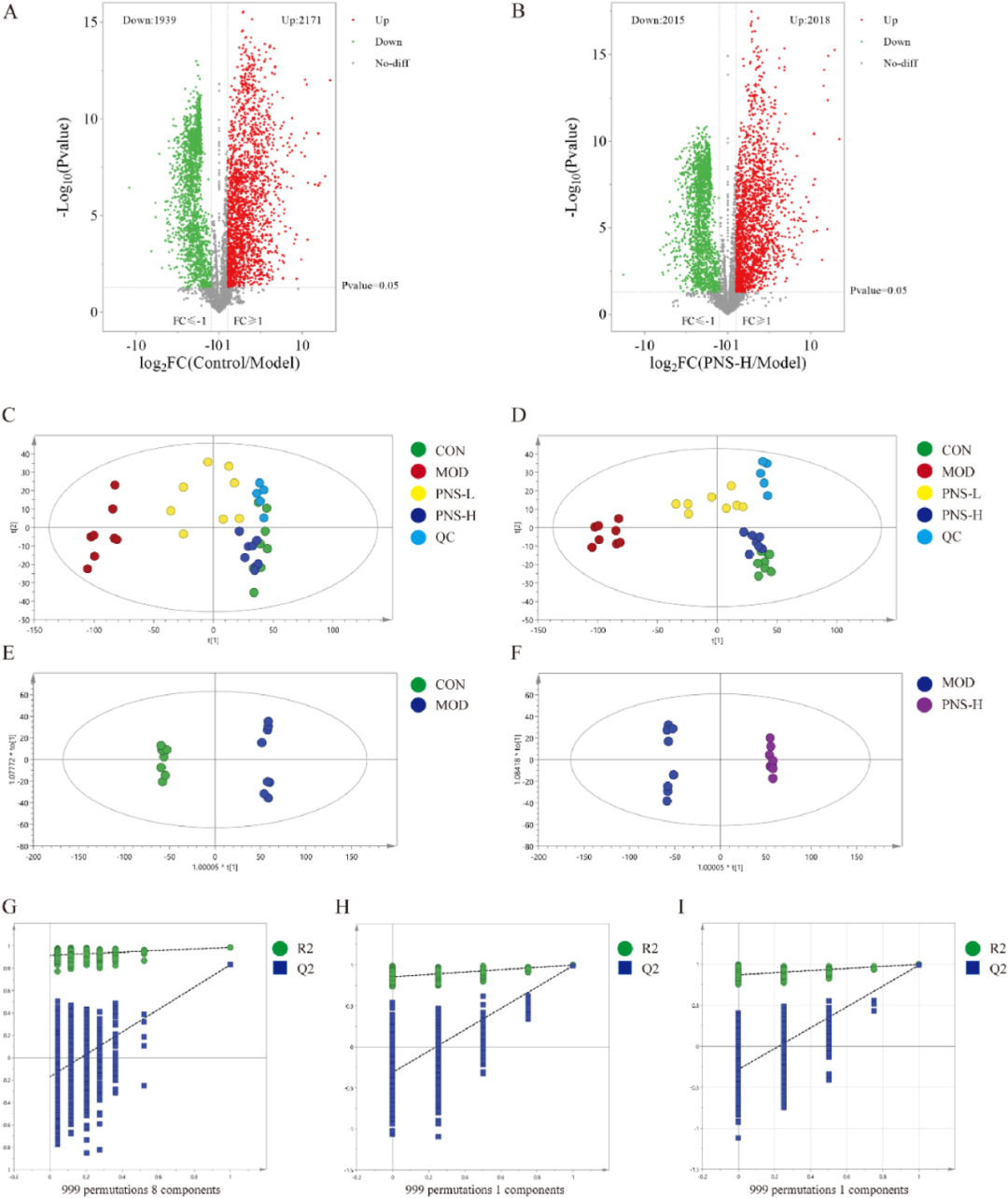
图3 代谢组学分析
网络药理学分析结果
研究通过分析CTD和Swiss Target Prediction数据库中的数据,确定了受PNS五个成分调控的291个靶点,并据此构建了一个C-T网络(图4A)。此外,研究从Genecards数据库中收集了6360个与睡眠障碍和认知障碍相关的基因数据,其中234个基因与PNS成分存在关联(图4B)。GO分析结果揭示了包括激素反应、细胞迁移的正向调节以及类固醇激素反应在内的关键生物过程(图4C)。细胞成分方面,涉及膜筏、质膜外侧以及细胞质的核周区。分子功能方面,包括蛋白质结构域特异性结合、蛋白激酶结合和类固醇结合。
前20个KEGG分析富集结果显示,相关过程涉及癌症、脂质代谢、动脉粥样硬化以及PI3K-Akt信号通路(图4D)。为深入理解PNS对CSD诱导的认知障碍的影响机制,研究构建了一个“通路-靶点”网络,该网络包含了前20条通路及其富集的靶点(图4E)。该网络由259个节点构成,包括5种化学物质、20条通路、234个靶点和1218条边。PI3K-Akt信号通路显示出最多的靶点连接(度数=156),其次是脂质和动脉粥样硬化通路(度数=121)、癌症通路(度数=76)等。蛋白质相互作用(PPI)网络数据来源于String数据库,其中234个共同靶点已被输入该数据库,网络包含231个节点和5767条边(图4F)。
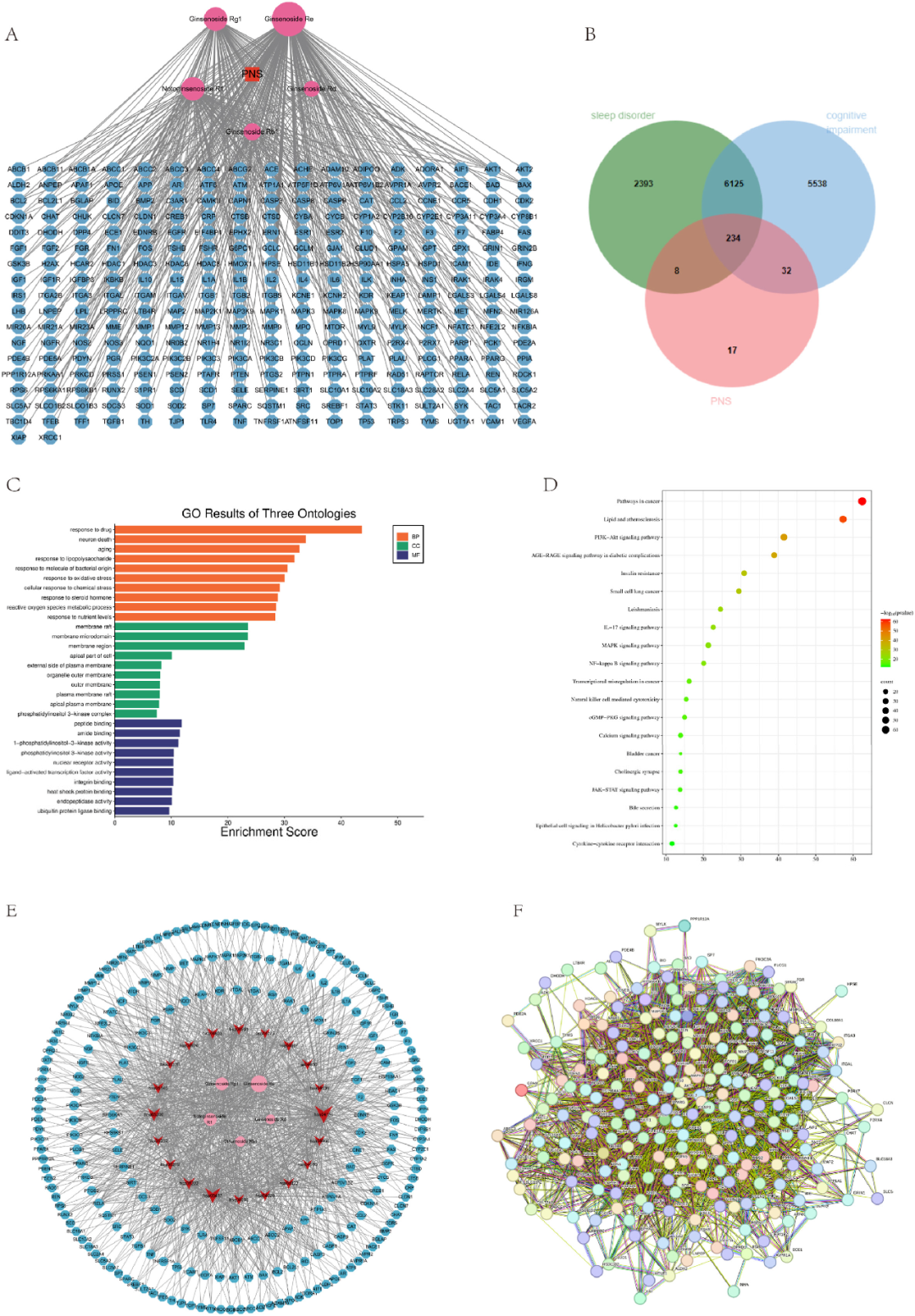
图4 网络药理学分析
结论
总之,研究证实PNS在改善由CSD引起的认知功能障碍,包括学习和记忆能力的损害,以及缓解海马区神经元损伤方面具有积极作用。此外,该研究还揭示了PNS治疗由CSD引起的认知缺陷的多种机制和作用靶点,为PNS的新用途开发及草药研究策略的创新提供了理论依据。
参考文献:
Zhang MY, Yin C, Ding L, Cheng L, Lv Q, Wang P, Zhang SB, You QY. Mechanism of Panax notoginseng saponins in improving cognitive impairment induced by chronic sleep deprivation based on the integrative analysis of serum metabolomics and network pharmacology. J Ethnopharmacol. 2024 Oct 22;337(Pt 3):118988. doi: 10.1016/j.jep.2024.118988


