湖南大学刘剑波教授《自然·通讯》: 定向组装的DNA三链体作为人工受体实现跨膜信号转导
时间:2024-11-17 11:03:53 热度:37.1℃ 作者:网络
跨膜信号转导是一种基本的生物过程,细胞通过跨膜蛋白质受体感知和响应环境中的各种化学或物理信号,进而激活细胞内部启动一系列生化反应级联。通过化学工具在人工细胞中重构复杂的信号转导过程不仅对了解生命过程至关重要,而且在合成生物学、生物传感、材料科学和生命起源研究中也大有可为。

近期,湖南大学刘剑波教授课题组发展了基于DNA三链体的人工受体,模拟了天然G蛋白偶联受体的跨膜结构功能。该研究利用定向胆固醇标记的三链DNA(TD)作为人工合成受体,通过H+介导的TD从双链到三链的构象转换,在脂质双层膜上传递和放大信号。作者通过辅助序列与TD的第三链互补,确保胆固醇标记的TD在膜上可控并倾向于向膜外定向。在外部H+的刺激下,构象变化会触发第三条链从膜外易位到膜内,从而实现有效的跨膜信号转导。这种机制实现了囊泡内的荧光共振能量转移(FRET)、选择性光裂解、催化信号放大和逻辑门调控(图1)。这项研究为生物传感、细胞信号调制和靶向给药系统中的应用奠定了基础。相关工作以“Oriented triplex DNA as a synthetic receptor for transmembrane signal transduction”为题发表在Nature Communications。
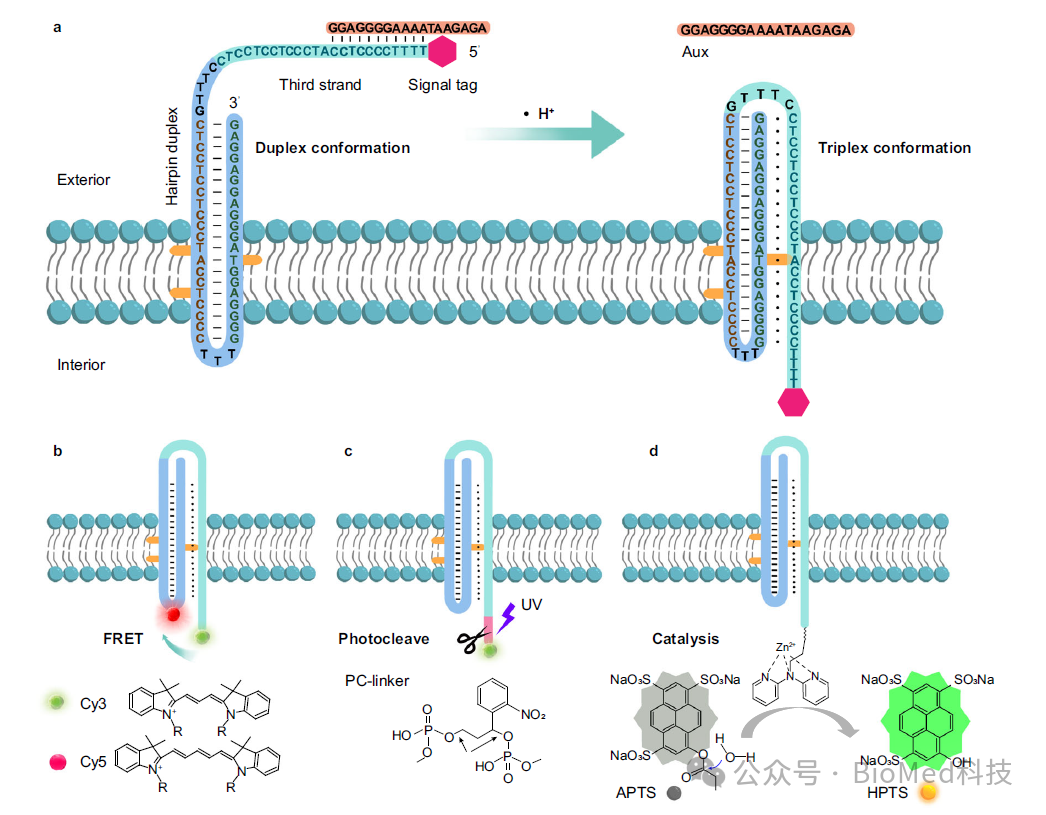
图1. 定向组装的DNA三链体作为人工受体用于跨膜信号转导。
首先,为了增强胆固醇标记的TD在膜上的向外定向趋势,作者引入了一段辅助序列,该序列部分与TD第三链的部分序列互补。该辅助序列具有强的空间位阻和亲水结构域,阻止了TD在膜上的随机锚定,并促进DNA受体的可控向外定向(图2)。这是实现信号跨膜转导的前提要求。
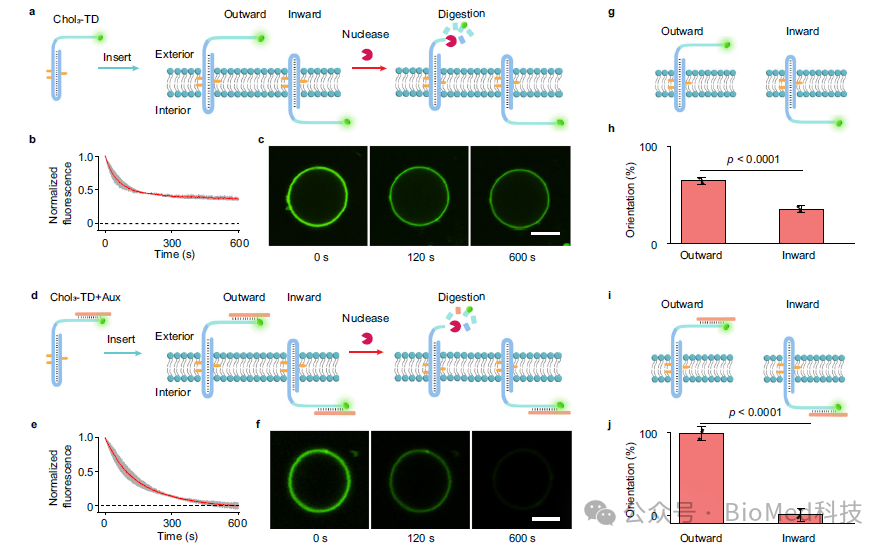
图2. 辅助链介导的胆固醇标记TD在膜上的定向锚定
进一步,为了研究DNA受体在膜界面处的动态变化,作者通过使用FRET分析方法检测了膜界面上DNA受体从双链到三链的转变,结果表明在被外界H+激活后,DNA受体的构象变化是个快速的动态过程,FRET效率增加了约14.7倍。并且研究结果表明,TD受体上暴露在膜外叶双链骨架上的toehold序列在跨膜易位中起着至关重要的作用。
接着,为了验证三链体的形成是否介导了信号模块的跨膜转运,作者利用连接到第三条链上的光裂解连接体(PC-linker)作为信号输出模块。结果表明在高pH值(pH 7.5)条件下,紫外线照射20分钟会导致囊泡外部荧光逐渐增加,而内部荧光没有明显变化。在低pH(pH 5.5)条件下,紫外线照射会导致囊泡内部荧光逐渐增加。这些观察结果表明,低pH诱导了DNA受体的构象变化和三链体的形成与信号模块的易位有关,信号模块从膜外易位到膜内,从而导致在膜内叶产生信号。
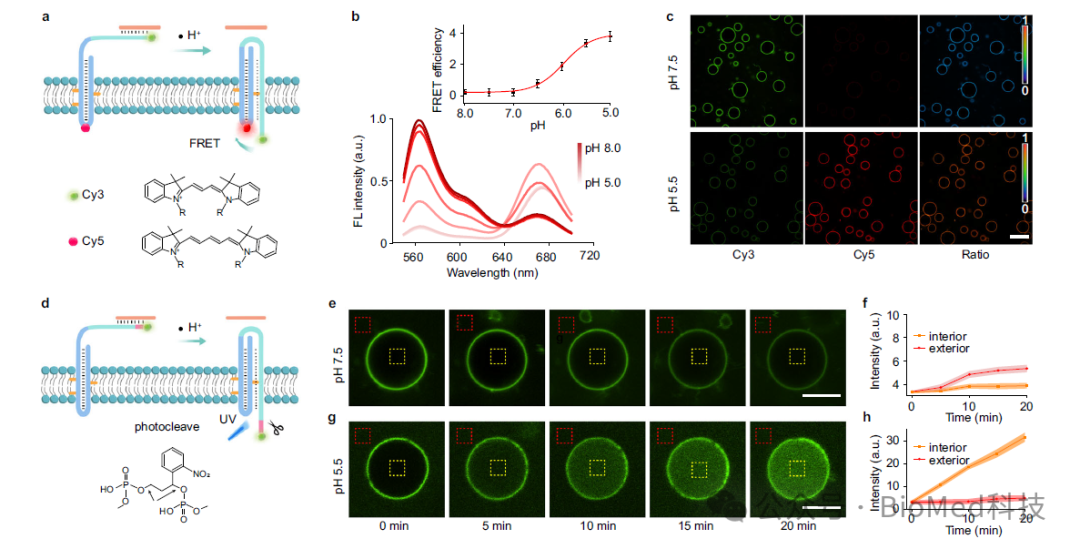
图3. H+介导的跨膜TD受体的构象变化用于跨膜FRET和光裂解信号输出
然后,作者构建了催化剂前体标记的信号模块,进一步研究了三链体形成介导的跨膜催化信号放大。该催化前体二吡啶基胺基团能与囊泡内部的Zn2+配位,形成具有模拟水解金属酶的的功能模块,能催化羧酸酯的水解,将低荧光底物转化为强荧光产物而输出放大信号。
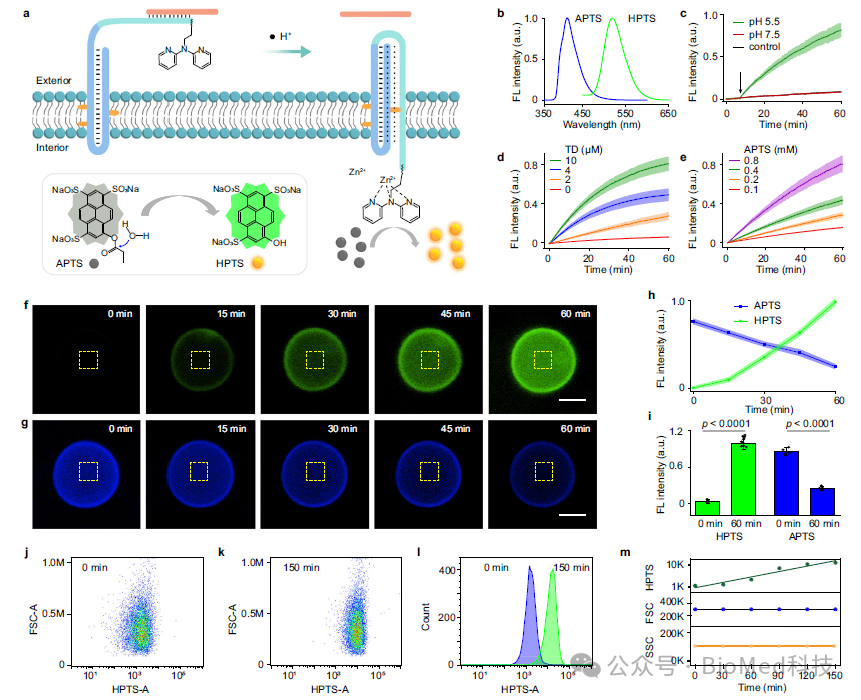
图4. 催化剂前体作为信号模块用于跨膜荧光催化
为了进一步开发TD人工受体的功能多样性,作者利用DNA逻辑计算的天然优势来拓展应用。由于与TD第三链部分互补的短寡核苷酸序列,在低pH条件下,第三链由于更强的Hoogsteen氢键作用而优先与双链发夹形成三链体而使得与辅助序列解离。而通过增加辅助序列的长度会加强其与第三链的结合,从而防止解离。于是,为了激活受体的构象变化,系统就需要引入cDNA作为熵驱动输入来取代辅助序列,由此作者构建了AND逻辑门控,以实现双输入逻辑控制的跨膜信号转导(图4)。
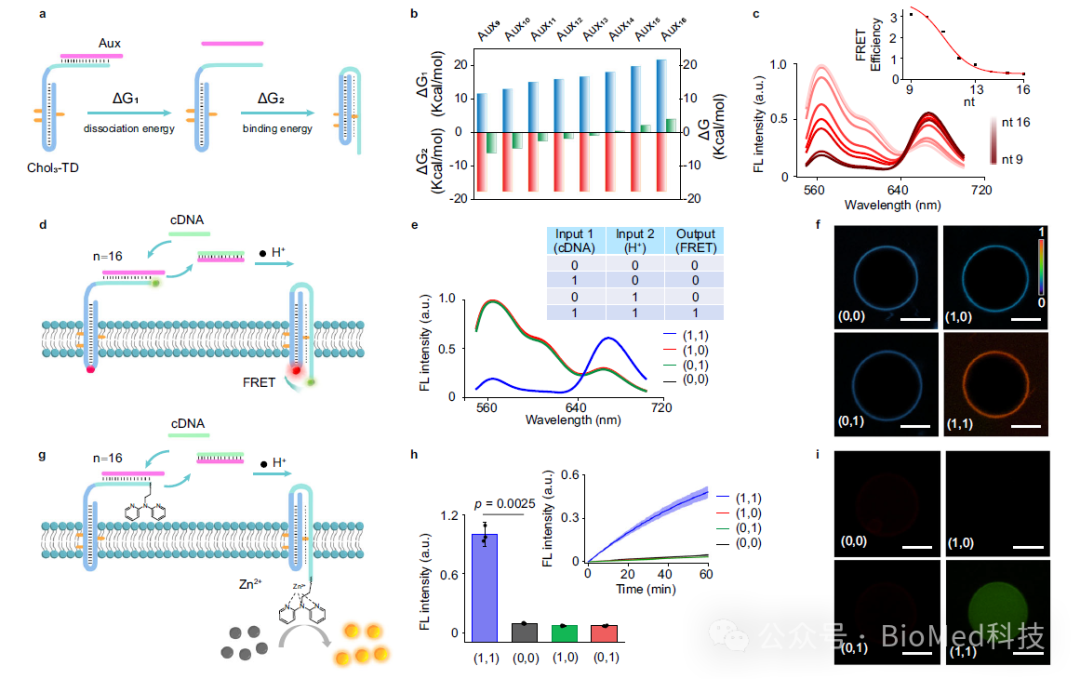
图5.基于合成受体AND逻辑控制用于跨膜信号转导与放大
【文章结论与讨论,启发与展望】
这项工作为人工受体的合成提供了一种以模块化、可编程性和可控性为特征通用的设计思路。它证明构象变化是合成系统中跨膜信号转导的有效机制,它在囊泡中整合了定向膜固定、刺激响应、构象转化与催化活化等过程。尽管基于TD的合成受体在结构和功能上比天然G蛋白偶联受体(GPCRs)更简单,但它们也表现出了合成受体所需的基本特征。这种合成方法为设计能够控制细胞活动的新型化学工具提供了可能性。因此,这项研究为开发对各种化学信号敏感的囊泡系统铺平了道路,最终为发展能够与生物系统互动和交换信息的生物纳米技术奠定了基础。
通讯作者简介:
刘剑波,湖南大学教授,博士生导师。2011年湖南大学博士毕业以后留校工作,期间在英国布里斯托大学开展博士后/访问学者研究。围绕人工细胞的仿生构建与生物医学应用开展研究,发表学术论文100余篇,包括 Nat. Chem., PNAS, Nat. Comm., J. Am. Chem. Soc., Angew. Chem. 等通讯作者论文60余篇。授权发明专利 11 项。
课题组主页:
https://grzy.hnu.edu.cn/site/index/liujianbo
论文信息:
https://www.nature.com/articles/s41467-024-53960-5


