胰腺癌研究表明,iNKT细胞的瘤内积累通过刺激IFN-I产生、协调免疫细胞浸润,介导肿瘤免疫反应
时间:2024-11-21 19:00:26 热度:37.1℃ 作者:网络
亮点
1.iNKT细胞是形成免疫反应性肿瘤微环境和胰腺癌适应性免疫所必需的。
2.iNKT细胞通过表面CD40L分子与髓系细胞表达的CD40相互作用,从而刺激IFN-I的产生,介导胰腺癌免疫反应。
3.亚叶酸(FA)通过诱导iNKT细胞积累,有望成为治疗胰腺癌的候选药物。
胰腺癌是一种起源于胰腺导管上皮及腺泡细胞的恶性肿瘤,被医学界称为“癌中之王”。 胰腺导管腺癌(PDA)是最常见的胰腺癌,其5年总生存率仅为9%左右,是癌症相关死亡的常见原因。目前,手术切除是PDA最有效的治疗方法,然而,由于局部进展或远处转移,确诊时仅20%的患者有手术机会。因此,寻找PDA的有效疗法势在必行。
恒定自然杀伤T(iNKT)是CD1d限制性的先天类T细胞,同时表达T细胞受体和NK细胞标记。iNKT细胞是人类和小鼠NKT细胞的主要群体,分别在人和小鼠体内表达恒定的Vα24-Jα18链和Vα14-Jα18的α链。已有研究表明iNKT细胞在癌症的免疫监视中发挥重要作用。
那么, iNKT细胞是否能够为胰腺癌的免疫疗法提供新思路呢?
近期,一项题为Intratumoral NKT cell accumulation promotes antitumor immunity in pancreatic cancer的研究表明,PDA肿瘤内部的iNKT细胞能够促进I型干扰素的产生,从而启动抗肿瘤适应性免疫反应,并协调T细胞、树突状(DC)细胞、自然杀伤(NK)细胞的瘤内浸润,成为免疫疗法的新型潜在靶点。

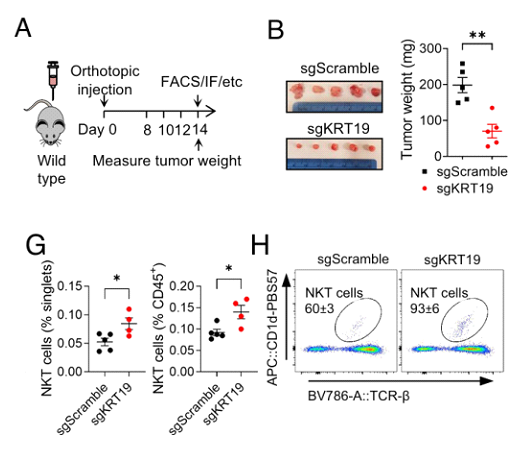
首先,研究人员采用了胰腺分子标志物(KRT19)缺陷小鼠以评估PDA肿瘤微环境的免疫细胞群和信号通路。他们发现与正常小鼠相比,模型鼠的PDA肿瘤尺寸更小,免疫T细胞更为明显的浸润到肿瘤内部,DC细胞、NK细胞和iNKT细胞也在肿瘤中心聚集,这表明经KRT19缺失激活了PDA肿瘤免疫。
KRT19缺陷小鼠的肿瘤尺寸及免疫细胞含量
随后,他们构建了iNKT细胞缺陷小鼠,以进一步研究其在PDA肿瘤免疫监视中的潜在作用。有趣的是,他们发现与野生型小鼠肿瘤相比,KRT19/iNKT双缺陷小鼠体内肿瘤不再缩小,肿瘤中心部位T细胞浸润无显著差异,其它瘤内免疫细胞的数量相似。iNKT细胞的缺乏“抵消”了KRT19介导的肿瘤免疫反应,说明iNKT细胞是形成免疫反应性肿瘤微环境和PDA肿瘤适应性免疫所必需的。
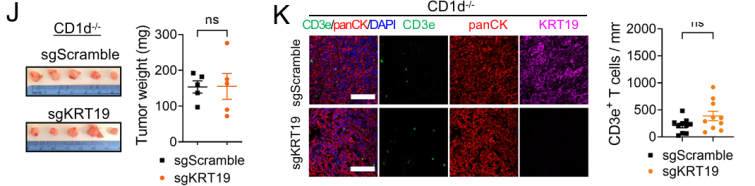
PDA中的抗肿瘤免疫
那么,iNKT细胞是如何介导KRT19缺失下的肿瘤反应呢?
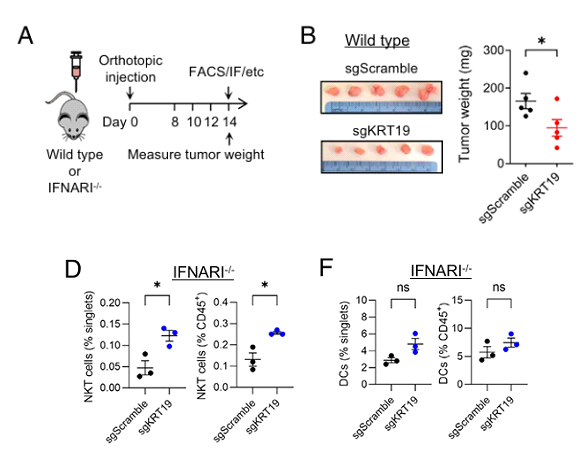
为解决这一问题,研究人员对PDA肿瘤进行了大量的RNA测序和基因组富集分析。结果显示,iNKT细胞在KRT19缺失的PDA肿瘤反应中起着产生Ⅰ型干扰素(IFN-I)的作用。众所周知,IFN-I能够抑制肿瘤细胞的增殖和分化,促进肿瘤细胞凋亡,从而发挥抗肿瘤作用。为进一步明确IFN-I是否与iNKT细胞介导的免疫反应有关,他们构建了IFN-α受体I基因敲除小鼠进行了后续研究。
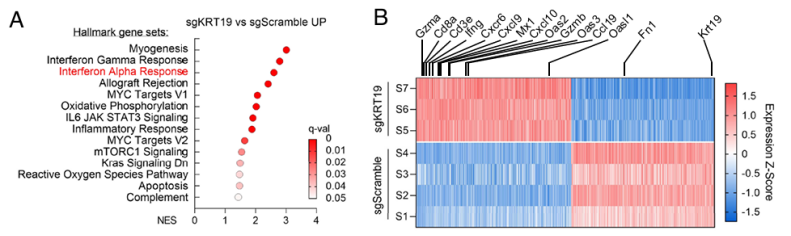
sgKRT19编辑肿瘤中的iNKT细胞和I型IFN
研究人员将sgKRT19编辑的PDA细胞接种到 IFN敲除小鼠体内。出乎意料的是,他们发现在IFN敲除的情况下,KRT19不再引发肿瘤尺寸缩小和免疫细胞浸润减弱;另一方面,iNKT细胞在瘤内的存在并不依赖于IFN信号转导。种种迹象表明,iNKT细胞是IFN-I信号的上游,也是KRT19引发的肿瘤适应性免疫反应的上游。
IFN-I和KRT19对PDA肿瘤的免疫控制
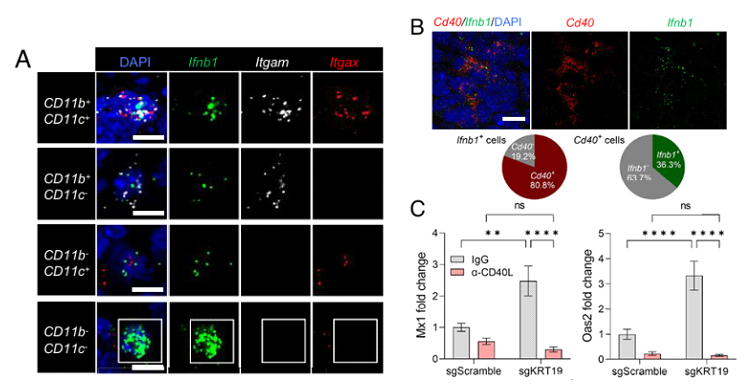
之后,研究人员通过RNA荧光原位杂交技术,进一步确定了髓系细胞是IFN-I的主要来源。此外,CD40分子信号也可能参与调控IFN-I的生成。因此,他们大胆的猜测,iNKT细胞可能通过其表面CD40L分子与髓系细胞表达的CD40相互作用,从而刺激IFN-I的产生。
分子信号的荧光定位
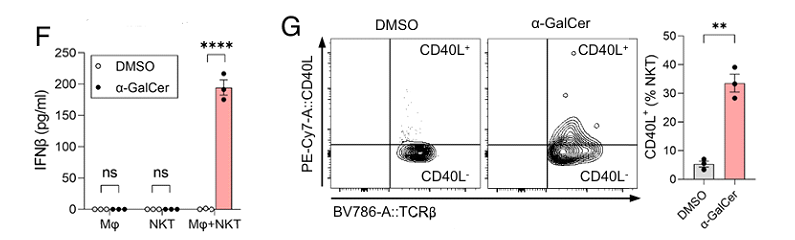
为验证这一假设,研究人员从小鼠肝脏中纯化了iNKT细胞,与腹腔巨噬细胞共培养,并用α-半乳糖甘油酰胺(α-GalCer)激活。果不其然,在α-GalCer刺激下,iNKT细胞和巨噬细胞共培养物的上清液中检测到IFN,iNKT细胞表面增加了CD40L的表达,iNKT细胞在体外通过表达激活后的CD40L来调节骨髓单核细胞产生IFN-I。
IFN产生和CD40L含量
最后也是最为重要的是,人们能否利用iNKT细胞来选择治疗胰腺癌的药物呢?
巧合的是,亚叶酸(FA)已被证明可诱导小鼠肠道中的iNKT细胞聚集。于是,研究人员给小鼠口服一定剂量的FA,发现小鼠体内多种免疫应答通路被激活,iNKT细胞积累增加,IFN-I信号上调;更令人惊喜的是,当FA与抗PD-1(一种重要的免疫抑制分子)抗体联用时,超过一半的受试小鼠体内肿瘤生长率降低两倍。这些发现表明,FA可能是增强PDA免疫检查点阻断的候选药物。
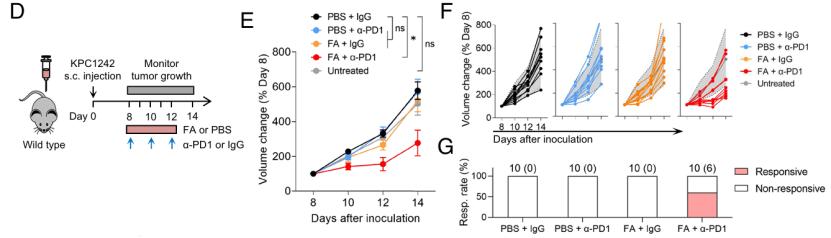
FA、与抗PD-1抗体联合治疗缓解肿瘤
总的来说,这项研究启发我们,iNKT细胞通过促进先天性免疫细胞因子IFN-I的生物合成,启动适应性抗肿瘤免疫反应,从而在PDA治疗中发挥重要作用。随着科技医疗的逐渐深入,iNKT细胞疗法必将为更多胰腺癌患者带来希望!
来源:
微信公众号: 基因启明
参考文献:
Li J, Moresco P, Fearon DT. Intratumoral NKT cell accumulation promotes antitumor immunity in pancreatic cancer. Proc Natl Acad Sci U S A. 2024 Jul 16;121(29):e2403917121. doi: 10.1073/pnas.2403917121. Epub 2024 Jul 9. PMID: 38980903.