汪海林/李向军合作《The EMBO Journal》:揭示基因组DNA 6mA修饰掺入严格受控
时间:2023-07-03 13:05:22 热度:37.1℃ 作者:网络
高等哺乳动物DNA N6-甲基腺嘌呤(6mdA)是表观遗传学领域的一个研究热点。前期工作中,汪海林研究团队1与Musheev研究团队2独立发现哺乳动物基因组中存在DNA聚合酶依赖的以N6-甲基-2’-脱氧腺苷三磷酸(6mdATP)为底物掺入至复制或修复的DNA而形成的掺入型6mdA(i6mdA)。生理上,与具有表观遗传学效应的甲基化DNA 6mdA一样,i6mdA同样会影响碱基配对和双螺旋构象,进而影响DNA复制和转录3,4。Musheev团队认为,细胞内存在丰富的RNA N6-甲基腺嘌呤(m6A)修饰,其降解后产生的大量m6rA核苷及其磷酸化产物可能通过核酸补救合成途径转化掺入至DNA,形成i6mdA2。然而,与Musheev团队的研究结果不同,汪海林团队在他们所研究的细胞中检测到的i6mdA源自外源m6rA核苷1。因此,他们认为,机体内RNA m6A降解转化形成i6mdA的通路应该受到严格控制,但具体机制目前尚不清楚。

2023年6月27日,中国科学院生态环境研究中心汪海林研究组与中国科学院大学李向军研究组合作在《The EMBO Journal》杂志在线发表题为“Aberrant DNA N6-methyladenine incorporation via adenylate kinase1 is suppressed by ADAL deaminase-dependent 2’-deoxynucleotide pool sanitation”的工作。该工作揭示了哺乳动物中存在的阻断DNA 6mdA错误掺入的2’-脱氧核苷酸库清除机制(2’-deoxynucleotide pool sanitation),并找到了该机制相关的调控因子脱氨酶ADAL(Adenosine deaminase like protein)和腺苷酸激酶AK1(Adenylate kinase 1)。
首先,汪海林/李向军团队利用他们已建立的稳定同位素示踪技术结合超灵敏的高效液相色谱串联质谱(UHPLC-MS/MS)的分析方法5,追踪哺乳动物细胞中RNA N6-甲基腺嘌呤修饰的代谢。同位素示踪技术可以避免6mdA分析过程中原核生物(细菌、支原体等原核生物DNA中含有高丰度的6mdA修饰)污染,而超灵敏的UHPLC-MS/MS可以实现对哺乳动物中痕量6mdA修饰的准确定量。示踪结果显示哺乳动物细胞中大量RNA m6A修饰(>60%)被成功标记,同时胞内也检测到了丰富的标记的RNA m6A降解产物(游离m6rA核苷及其磷酸化产物)。然而胞内却没有出现稳定同位素标记的游离6mdA核苷及其磷酸化产物,且在大多数测试细胞系中也未检测到标记的i6mdA(即源自RNA m6A降解的i6mdA), 仅在少数细胞株中检测到稀少的标记的i6mA (NIH3T3和C2C12细胞)(图1)。这些结果提示哺乳动物细胞内存在阻断DNA 6mdA错误掺入的2’-脱氧核苷酸库清除机制(2’-deoxynucleotide pool sanitation)。
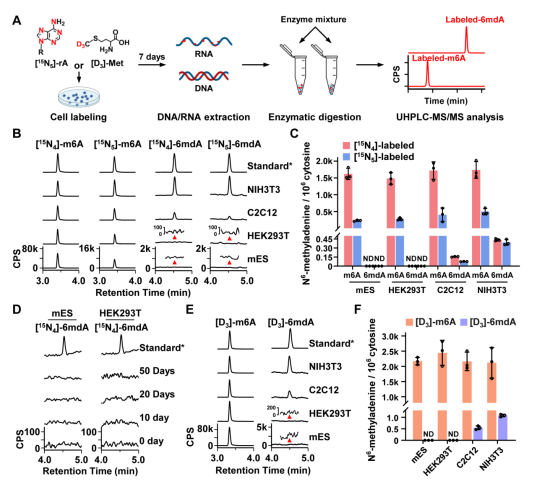
图1. 哺乳动物中RNA m6A降解产物掺入形成DNA 6mdA的过程受到严格控制
为了进一步探究参与调控该2’-脱氧核苷酸库清除机制的具体机制,汪海林/李向军团队先是找到了脱氨酶ADAL。体外实验显示,ADAL能够将N6-甲基腺苷单磷酸(m6AMP)和N6-甲基-2'-脱氧腺苷单磷酸(6mdAMP)分别转化为次黄嘌呤核苷酸(IMP)和次黄嘌呤脱氧核苷酸(dIMP),且对后者表现出更高的催化活性(2.14倍)(图2)。ADAL的这种双重催化活性是其参与调控DNA 6mA掺入的基础。随后,研究者发现脱氨酶ADAL的缺失会导致细胞内出现游离的6mdA核苷及其磷酸化产物,以及源自胞内RNA m6A降解的DNA i6mdA(图3和图4)。此外,对比存在i6mdA的NIH3T3和C2C12细胞与未检测到i6mdA的mES细胞中的Adal基因的表达水平,作者发现Adal的表达与i6mdA的水平呈现负相关(图3)。这些结果均表明ADAL参与抑制i6mdA的产生。
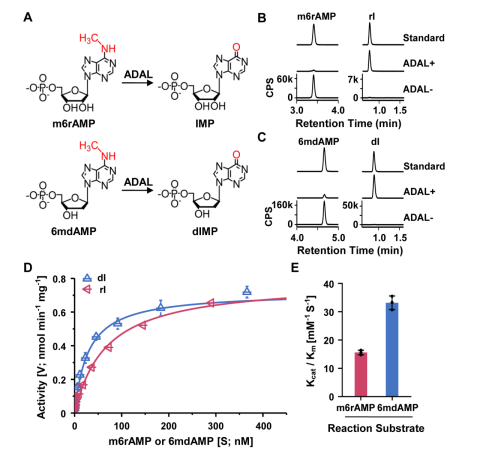
图2. 体外反应中ADAL对6mdAMP具有更高的催化活性
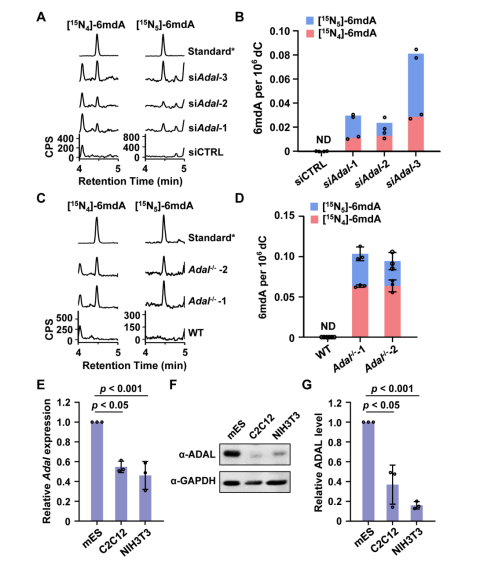
图3. ADAL缺陷导致细胞内DNA 6mdA的出现
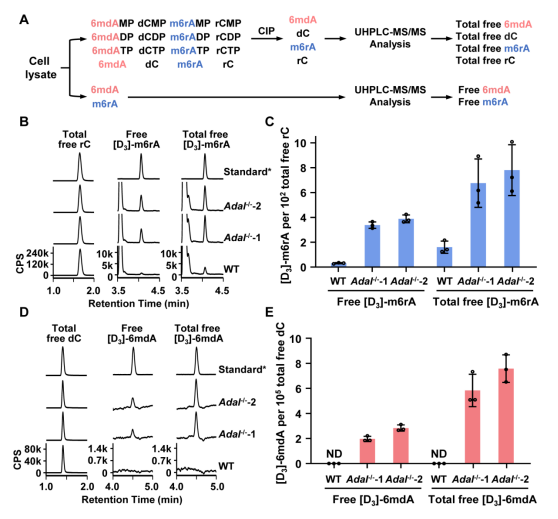
图4. ADAL在体内催化6mdAMP水解
此外,因为RNA到DNA之间的转化是通过核酸补救合成途径完成,所以研究人员筛查了该过程的关键代谢激酶,以寻找潜在的i6mdA掺入的调控因子。他们发现腺苷酸激酶AK1的过表达促进ADAL缺陷细胞中i6mdA水平的升高,而Ak1的敲低则显著抑制i6mdA的产生(图5),说明AK1同样参与调控i6mdA的形成。
值得注意的是,汪海林/李向军团队在小鼠成纤维NIH3T3细胞和小鼠成肌C2C12细胞中检测到的i6mdA丰度(分别为0.42和0.14 6mdA per 106 dC)比这两个细胞系中已报道[2]的i6mdA丰度低约90-1000倍(图1和图6)。该结果同样支持哺乳动物细胞中i6mdA产生受到严格控制的结论。
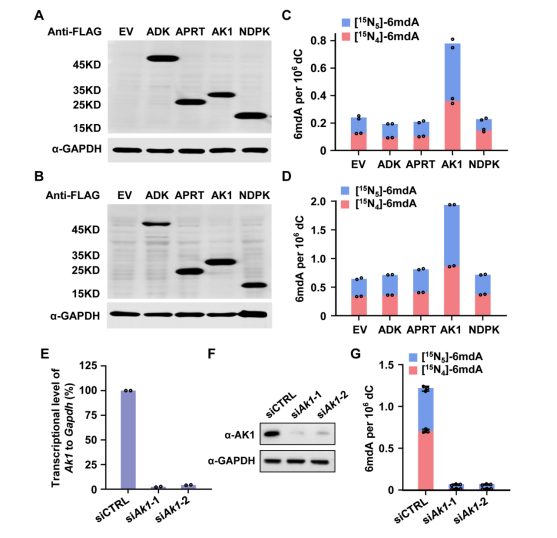
图5. AK1参与DNA 6mdA的掺入调控
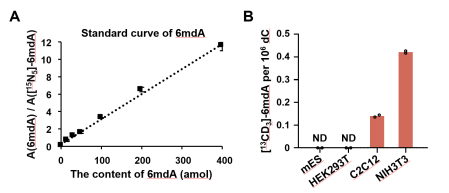
图6. 重复Musheev et al.工作中的方法定量mES、HEK293T、C2C12和NIH3T3中DNA i6mdA
综上所述,这项工作揭示了哺乳动物细胞中存在的抑制潜在DNA 6mdA错误掺入的2’-脱氧核苷酸库清除机制。脱氨酶ADAL以及其他调节因子(如焦磷酸酶MTH16)共同构成了该清除机制。而该机制的缺陷(如在NIH3T3细胞中)和腺苷酸激酶AK1表达的上调会促进异常的6mdA掺入(图7)。该研究将有助于理解表观遗传DNA稳态的维持机制。
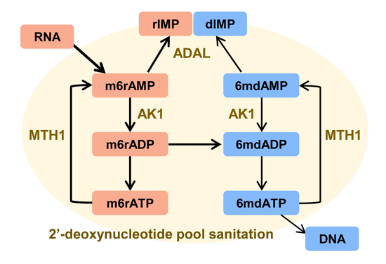
图7. 哺乳动物细胞内2’-脱氧核苷酸库清除机制抑制DNA 6mdA产生的机制示意图
中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室博士后陈少坤为论文的第一作者,汪海林研究员为通讯作者。中国科学院大学化学科学学院李向军教授为共同通讯作者。
参考文献:
1、Liu, X. et al. N6-methyladenine is incorporated into mammalian genome by DNA polymerase. Cell Res. 31, 94-97 (2021).
2、Musheev, M. U., Baumgartner, A., Krebs, L. & Niehrs, C. The origin of genomic N6-methyl-deoxyadenosine in mammalian cells. Nat. Chem. Biol. 16, 630-634 (2020).
3、Wang, W. et al. Epigenetic DNA modification N6-methyladenine causes site-specific RNA polymerase II transcriptional pausing. J. Am. Chem. Soc. 139, 14436-14442 (2017).
4、Li, B. et al. Epigenetic DNA modification N6-methyladenine inhibits DNA replication by DNA polymerase of Pseudomonas aeruginosa Phage PaP1. Chem. Res. Toxicol. 32, 840-849 (2019).
5、Liu, B. et al. Metabolically generated stable isotope-labeled Deoxynucleoside code for tracing DNA N(6)-methyladenine in human cells. Anal. Chem. 89, 6202–6209 (2017).
6、Scaletti, E.R. et al. MutT homologue 1 (MTH1) removes N6-methyl-dATP from the dNTP pool. J. Biol. Chem. 295, 4761-4772 (2020).
原文链接:
https://www.embopress.org/doi/epdf/10.15252/embj.2023113684


