EI:警惕!杨慧/王欣之/王频/杭渤团队合作发现三手烟暴露增加多种遗传背景下的肿瘤发生风险
时间:2023-03-24 10:32:45 热度:37.1℃ 作者:网络
三手烟 (THS) 被定义为在停止主动吸烟后吸附在室内表面和灰尘中的残留烟草烟雾,一些吸附的成分可以重新排放到气相中和/或与其它环境污染物反应形成有害化合物。越来越多的证据表明,接触三手烟 THS可能会对健康造成不良影响。国际上对于THS暴露与人类癌症风险相关性的证据仍在不断积累中。
2023年3月20日,武汉大学附属中南医院杨慧、南京中医药大学王欣之、南京大学附属鼓楼医院王频等联合美国劳伦斯伯克利国家实验室杭渤团队在中科院一区Top环境科学期刊Environment International (IF=13) 在线发表题为“Thirdhand tobacco smoke exposure increases the genetic background-dependent risk of pan-tumor development in Collaborative Cross mice”的研究论文,该研究表明,早期 THS 暴露会增加复杂性状遗传(Collaborative Cross, CC)小鼠的肿瘤发展,并且宿主遗传背景在个体对THS 诱导的肿瘤发生的易感性中起着重要作用。在确定THS 暴露的人类癌症风险时,遗传背景是一个应该考虑的重要因素。
CC小鼠群体的模型系统反映了在人群中观察到的遗传和表型多样性。研究包括了八个 CC品系,以评估4至9周龄的短期环境剂量THS接触后的癌症风险。实验量化了18个月大时的泛肿瘤发生率、每只小鼠的肿瘤负荷、器官肿瘤谱和无肿瘤存活率。在种群层面,观察到与对照组相比,THS暴露小鼠的泛肿瘤发生率 (p = 3.04E-06) 和单只小鼠的肿瘤负荷显着增加 (p = 0.002742)。暴露于 THS 后,肺和肝组织发生肿瘤的风险最大。与对照组相比,经 THS暴露的小鼠的无肿瘤存活率显着降低 (p = 0.044)。在个体品系水平,观察到8种CC品系的肿瘤发生率存在很大差异。与对照组相比,在THS 暴露后,CC036和CC041 的泛肿瘤发生率显着增加(分别为 p = 0.0084 和 p = 0.000066)。综上所述,这些数据支持生命早期暴露于THS可能导致癌症的观点,并表明个体遗传背景在THS暴露诱发的癌症风险中起着关键作用。

与通常在数小时内消散的二手烟 (SHS) 相比,THS在停止吸烟后可以在室内环境中持续很长时间,从数天到数月,甚至超过一年不等。此外,非吸烟者可以通过多种途径接触 THS 污染物,包括非自愿吸入、摄入、皮肤吸收。儿童因其活动特点,通常比成人按触到更多的THS。此外,它们的生理特征,例如较低的毒素代谢能力和较高的毒素/体重比,可能使他们对与THS暴露相关的不利健康影响更加敏感。
除了 THS 中最普遍的成分尼古丁外,近年来已在空气中或物体表面 THS 中鉴定出 100 多种化合物,包括一些已被国际癌症研究机构 (IARC) 鉴定为已知或可能的致癌物,例如烟草特有亚硝胺 (TSNAs)、多环芳烃 (PAHs) 和苯。其中,尼古丁与环境污染物如亚硝酸或臭氧之间发生的化学反应得到了广泛的关注,因为通过SHS的老化过程会产生更多的有害化合物。有证据表明,在吸烟父母的家中,或者即使他们从不在家中吸烟,他们的孩子与不吸烟者的孩子相比,尿液中含有较高水平的 THS 成分,例如尼古丁和TSNAs。THS污染对公众健康提出了新的挑战,特别是对于婴幼儿,他们在生命早期暴露于环境中可能代表健康负担更高的群体。
一个重要的问题是THS 暴露是否会增加人群中的癌症风险。美国劳伦斯伯克利国家实验室杭渤教授团队一直致力于使用化学、分子、体外和动物模型系统来解决这个问题。团队既往研究表明,在环境相关剂量下,THS暴露会导致培养的人类细胞发生各种分子和细胞变化,包括 DNA链断裂、氧化碱基损伤、DNA加合物和微核形成。使用小鼠模型,团队既往研究观察到早期 THS暴露会损害 C57BL/6小鼠的免疫功能和 A/J 小鼠的肺癌发病率增加;但THS 暴露不会增加接受类似暴露的C57BL/6 小鼠的肿瘤风险,提示遗传背景在 THS 暴露后的癌症风险中起着重要作用。本研究利用的复杂性状遗传(Collaborative Cross, CC)小鼠为近年来开发的研究个体易感性的新型动物模型,其基因型和表型多样性已接近人类,且其自发性肿瘤的发生率及类型比较广泛,作为一种高度多样化和可复制的资源, CC小鼠用于研究和绘制复杂性状,包括炎症和肿瘤易感性已被国际广泛接受。
这项研究主要围绕两个目标:(1) 使用CC population-based 小鼠模型确认THS 是否会增加癌症风险;(2) 使用多种遗传上不同的 CC品系来探索遗传背景对 THS 暴露相关癌症风险的作用。
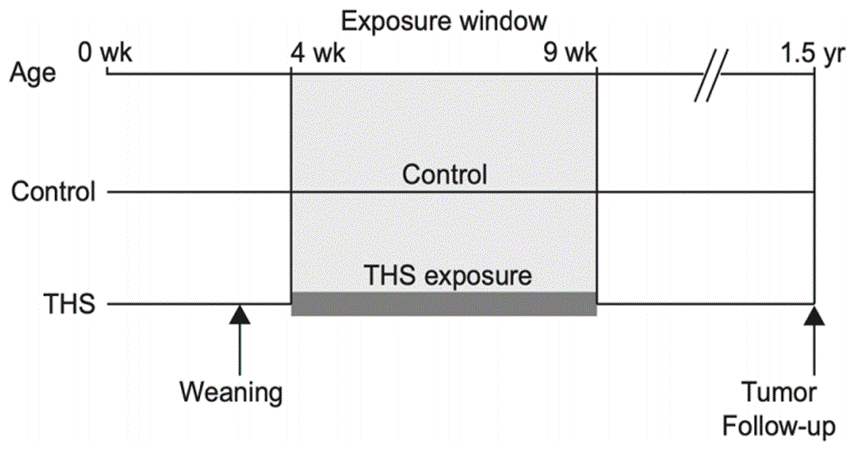
试验流程图(图源自Environment International )
这项研究已经成功地使用该系统来识别与各种THS暴露表型相关的遗传变异。实验随机选择了八种 CC 小鼠品系,CC001、CC019、CC026、CC036、CC037、CC041、CC042 和 CC051,每个 CC 品系都包含来自八个创始品系的独特基因组来源。虽然所有品系都会不同程度的自发形成肿瘤,但已知CC036 和 CC041具有相对较高的基线肿瘤发病率水平。本项研究发现THS 暴露显着增加CC小鼠队列中的总体泛肿瘤发生率 (p = 3.04E-06) 和单只小鼠的肿瘤负荷(p = 0.002742),强烈表明早期接触THS是人类癌症发展的风险因素。另外,本研究也表明CC小鼠模型为研究THS 暴露后各器官的肿瘤在不同自发性癌症风险背景下的发展提供了一个定性和定量的实验系统,使其成为人类烟草烟雾研究风险评估的便捷工具。
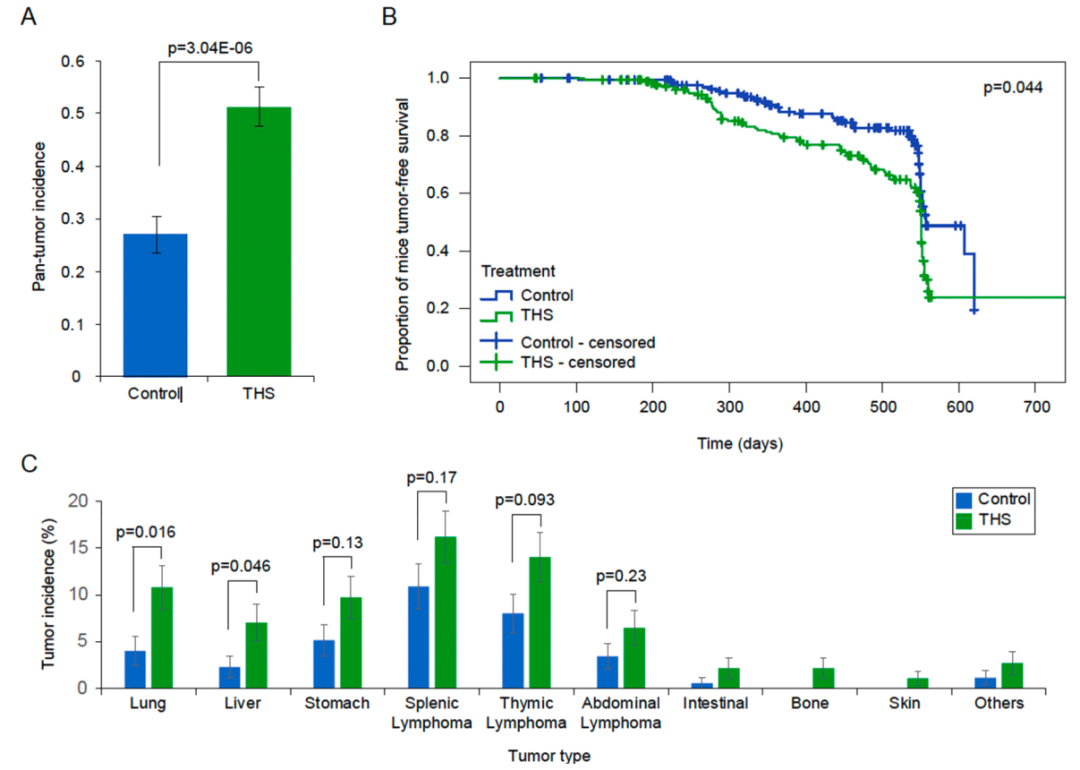
对照组和经THS暴露的CC小鼠的泛瘤发生率、无瘤生存率和肿瘤谱(图源自Environment International )
同时本项研究观察到每种品系的 THS暴露与肿瘤发生率和器官谱之间存在复杂的相互作用。正如预期的那样,CC36和CC041 分别表现出高自发水平的胃肿瘤和淋巴瘤。THS暴露显着增加了这些类型肿瘤的发病率。除此之外,THS 暴露也可能与其它类型的肿瘤的发生有关,包括例如 CC041 中的骨肿瘤,这在同一品系的对照动物中并未观察到。既往团队研究提出CC036可作为研究人类胃肿瘤发生的自发实验室小鼠模型,本研究进一步表明,THS暴露可以加速该模型中胃肿瘤的发展。未来的研究将需要确定基因-环境作用的分子机制。综上所述,三手烟暴露在不同遗传背景人群中的肿瘤易感性存在着显着不同。
武汉大学附属中南医院杨慧、南京中医药大学王欣之、南京大学附属鼓楼医院王频博士为该研究成果的共一作者。美国劳伦斯伯克利国家实验室Bo Hang、Jian-Huan Mao、Antione Snijders教授为共同通讯作者。本研究获得了美国加州烟草相关疾病研究计划(TRDRP)、NIH基金的支持。


