科济药业正式挂牌港交所,勇闯细胞治疗千亿市场!
时间:2021-06-18 18:02:18 热度:37.1℃ 作者:网络
2021年6月18日,科济药业于香港联交所正式挂牌上市,成为二级市场中的又一家中国细胞治疗企业。此次IPO吸引包括全球科技对冲基金Cloud Alpha,Dymon亚洲基金等机构的加持。
科济药业成立于2014年,是一家在中国及美国拥有业务的生物制药公司,专注于治疗血液恶性肿瘤和实体瘤的创新CAR-T细胞疗法。前身是科济生物,上市前重组并表后,科济生物为科济药业的附属公司。科济药业以解决CAR-T细胞疗法的重大挑战,比如提高安全性,提高治疗实体瘤的疗效和降低治疗成本。
自2017年,美国FDA批准了两种CAR-T细胞疗法——Kymria和Yescarta,从而成为了开启肿瘤免疫学领域的里程碑事件。到目前为止,全球已有5款CAR-T药物获批上市,Kymriah、Yescarta、Tecartus及Breyanzi均以 CD19为靶点及以BCMA为靶点的Abecma。目前在中国还未有CAR-T细胞疗法药物上市。
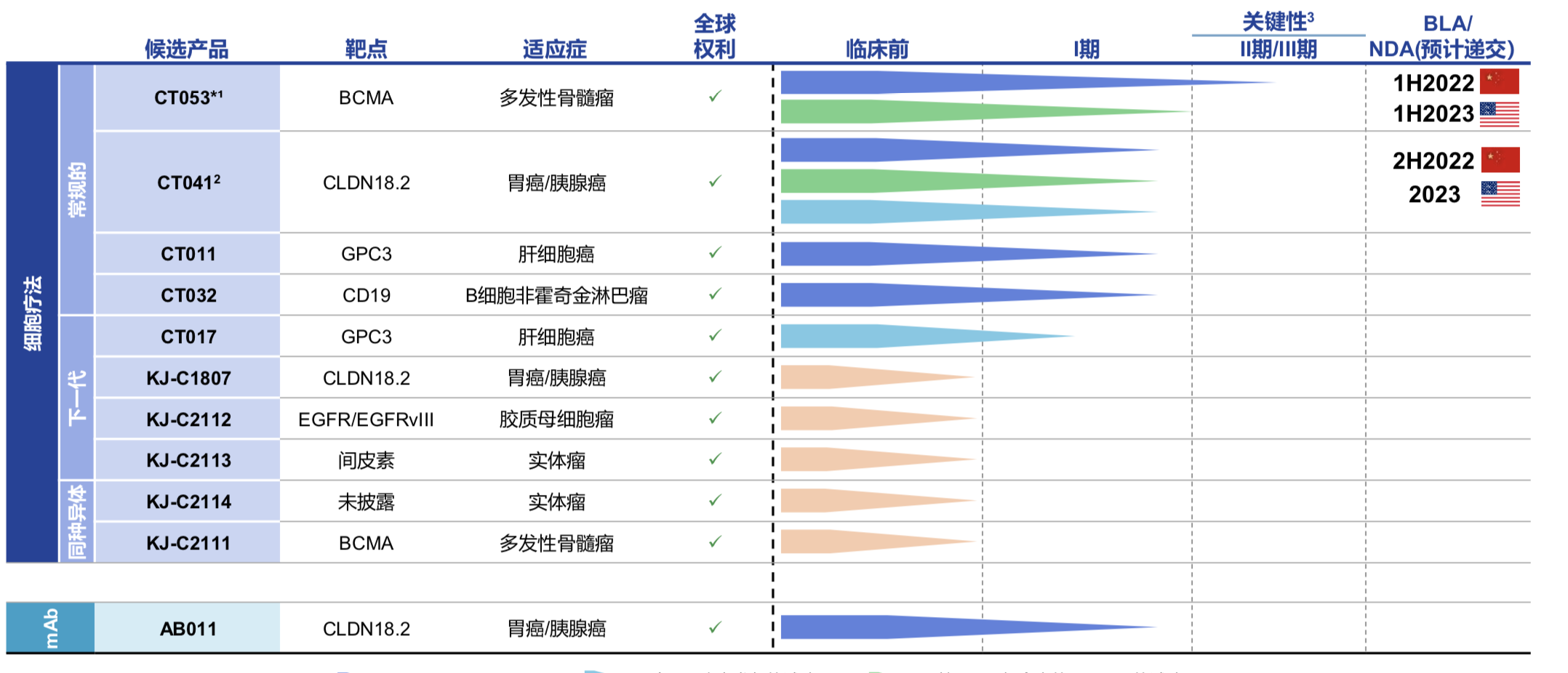
据悉,2019年-2020年底,科济药业两年经营亏损合计为人民币5.54亿元,而所亏损的资金90%以上用于研发。截止目前,科济药业已开发11款候选产品的差异化管线,10款是CAR-T细胞疗法,其中5款处于临床阶段,且大部分开发用于治疗实体瘤,包括胃癌、胰腺癌和肝细胞癌等,与此同时,科济药业已在中国、美国和加拿大获得7个CAR-T疗法的IND许可。
图片来源:科济药业
虽然目前科济药业还未有商业化产品,但其丰富的产品线颇具看点,如核心在研CAR-T药物 CT053 目前处于临床 2 期,进度位于国内第一梯队,也是最为成熟的产品之一。
CT053 主要用于治疗复发难治性多发性骨髓瘤,2019 年该产品获得美国 FDA 的孤儿药认定,并在 2020 年获得国家药监局的突破性治疗药物品种认定。CT053是拥有竞争优势的升级版全人抗BCMA CAR-T。CT053 CAR-BCMA T 由科济药业自主研发,采用全人抗体靶向 B 细胞成熟抗原( BCMA) 的嵌合抗原受体( CAR) 修饰的 T 细胞。
CT053目前主要的临床数据来自中国IIT试验,在对24名患者进行了6个月的随访发现,CT053实现了87.5%的客观缓解率和79.2%的完全缓解,中位持续缓解时长达到了21.8个月。据科济药业创始人李宗海博士表示,随着随访时间的延长,完全缓释率有可能进一步上升。CT053将在2021年底完成关键II期研究,计划在2022年及2023年分别在中国和美国递交NDA和BLA申请。
其实,在今年3月份,美国FDA已经批准BCMA CAR-T细胞治疗产品Abecma上市,用于治疗接受过四种以上前期疗法的复发/难治性多发性骨髓瘤的成年患者。结果显示,可评估疗效人群(n=100)的总缓解率为72%,28%的患者达到了严格的完全缓解,中位缓解持续时间为11个月。在28位获得sCR的患者中,65%(95% CI:42%-81%)的患者缓解持续至少12个月。
然而,在安全性方面,所有接受Abecma治疗的患者中,安全性状况良好,主要发生低水平的细胞因子释放综合征(CRS)和神经毒性(NT),并且具有可预测的早期发作和缓解。FDA在批准Abecma的时候,同样将CRS,NT,噬血细胞淋巴组织细胞/巨噬细胞活化综合征(HLH / MAS)和血细胞延长减少列为黑框警告。
CT053在安全性方面,表现出了明显的竞争优势。据目前所披露的研究数据显示,CT053所入组患者都没有出现3级及以上的CRS,NT的发生率也非常低。
对此,李宗海博士在采访中多次强调,CAR-T药物的安全性。CT053在保持疗效的同时保证了治疗的安全性,而这正是科济药业的一大优势。科济药业利用自己的抗体平台,通过全人噬菌体展示库和改进的杂交瘤技术,发现并优化对肿瘤靶点具有更高特异性和稳定性的抗体片段,从而减少了CAR-T细胞在没有肿瘤靶点的情况下的自动激活,控制细胞因子的释放水平,进而降低了CRS的发生率。
同时,值得一提的是,同样由科济药业自主研发的CT041 获得全球唯一靶向 CLDN18.2 的 CART-T 候选产品。CT041是一款人源化抗Claudin18.2 (CLDN18.2)自体CAR-T疗法,用于治疗CLDN18.2表达阳性,既往经系统治疗后出现进展或复发的晚期胃腺癌/食管胃结合部腺癌、胰腺癌。
有研究显示,CLDN18.2在胃癌、胰腺癌、结肠癌、肺癌、食管癌、卵巢癌等肿瘤中高表达。在胃癌中大约有50%~80%的患者有该靶点的表达。2019年,科济药业首次在国际发表针对CLDN18.2靶点的CAR-T细胞研究结果,发现CLDN18.2靶向的CAR-T细胞可以在小鼠体内高效消除胃腺癌,安全性良好,因此有望成为胃腺癌等肿瘤的新治疗手段。此外,CT011 是全球首款进入临床试验的靶向 GPC3 候选产品。
由于尚未有产品实现商业化,科济药业仍处于亏损阶段,尚未从产品销售中产生任何收益,最快实现商业化的CT053预计在中国或美国商业化时间是2022年和2023年。
CAR-T是一种经过基因修饰的T细胞,通过向患者DNA中导入编码CAR的基因对T细胞进行修饰,T细胞增殖后回输患者体内表达CAR,从而启动人体自然宿主防御机制,对靶细胞进行杀伤,从而达到比普通T细胞更强的定位攻击肿瘤细胞的能力。
根据美国专利商标局(USPTO)的数据,CAR-T专利在过去十年中呈现出急剧增长,平均发展速度为2.09,而专利人口的基线水平为1.05。然而,在这个快速增长的领域,还没有进行全面的专利分析。
与传统的小分子药物及抗体药物相比, CAR-T技术的专利布局更为复杂,涉及基础研究、工业制备、临床使用等多个环节。为此,通过专利扫描,来自澳门大学胡元佳教授团从“时间-空间-组织-技术”四个维度综合分析了CAR-T的全球专利布局,首次提供了该领域的专利技术“航拍图”。结果发表在最新的Nature biotechnology杂志上。
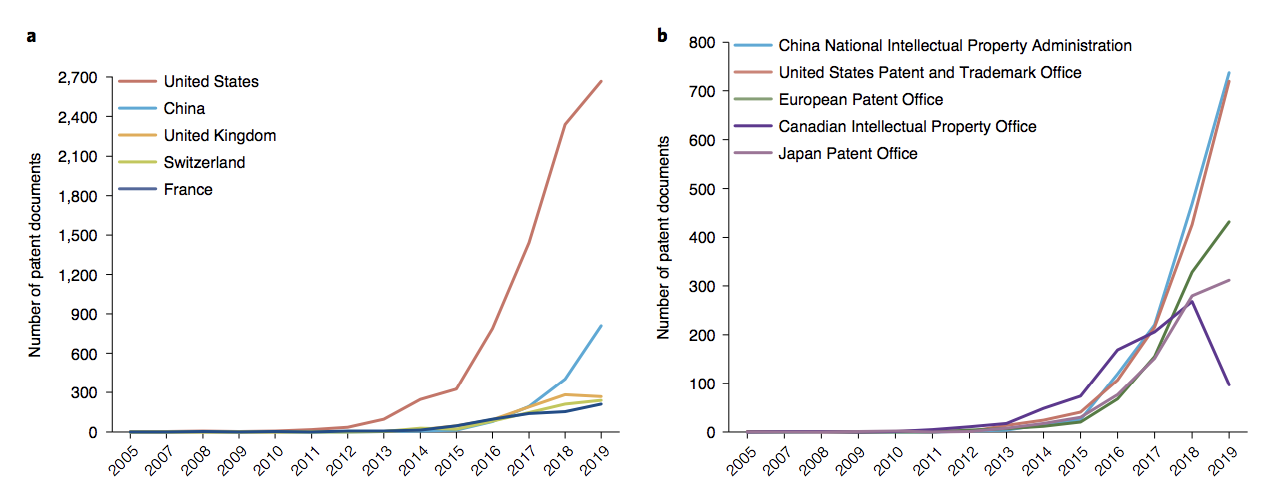
CAR-T专利的申请趋势
结果显示,前20名CAR-T发明者分别位于美国、英国和法国。其中,CAR-T的创造者之一、美国的Carl H. June是获得专利最多的人;其次是来自英国的Martin Pule和Shaun Cordoba。而在公司专利权方面,美国宾夕法尼亚大学、制药公司百时美施贵宝以及瑞士诺华公司分别位列前三。唯一挤进前20强专利拥有权的中国公司为科济生物医药有限公司,排名第18位。
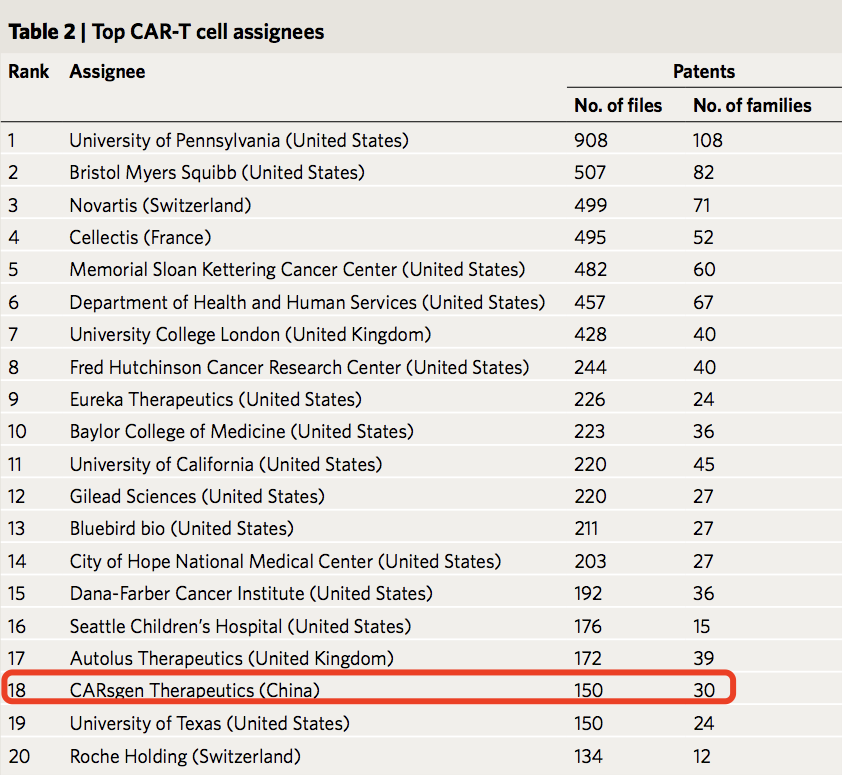
研究强调,中国的CAR-T研究发展不算早,但速度却十分迅速。目前,我国已成为全球第一的专利公开国、全球第二的专利权属国。然而,我们还是可以发现,我们与欧美强国还有很大差距——专利权机构虽然数量多,但规模小、缺乏合作和国际布局,导致在全球研发网络中处于边缘位置。
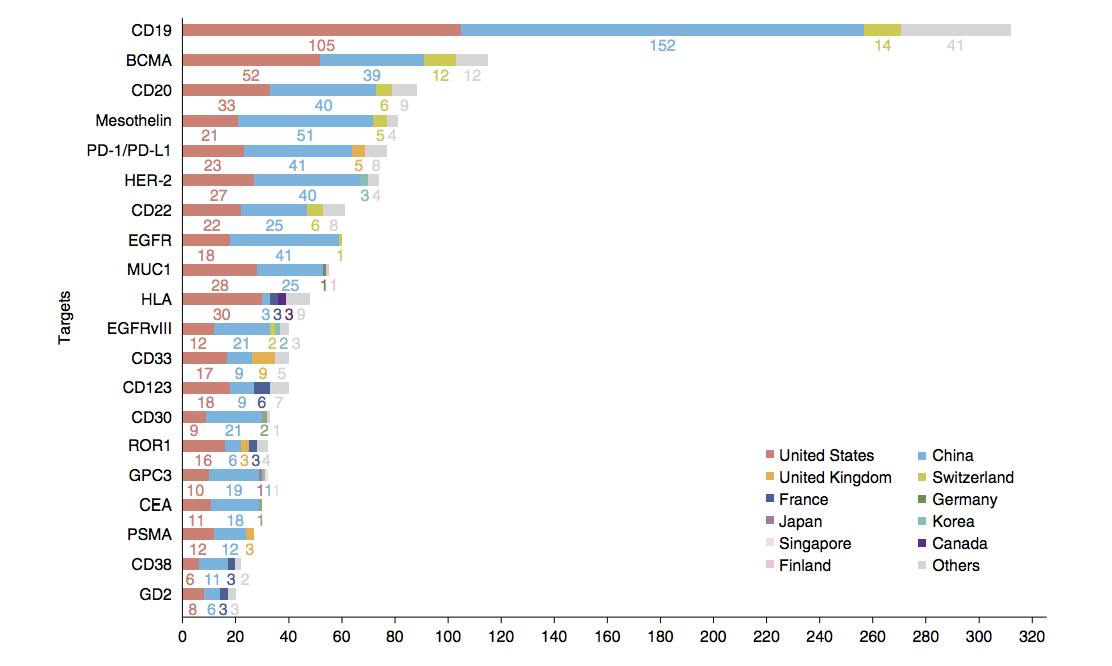
CAR-T治疗TOP20靶点
从全球的来看,目前CAR-T治疗靶点主要集中在CD19,BCMA,CD20,Mesothelin,PD-1/PD-L1和HER-2等。同时,中国的专利制度对其他国家进入中国也有很大影响。中国正在考虑创新型开发商能否在进入市场之前在中国获得专利批准,以阻止潜在的竞争对手。CAR-T技术卓越的临床疗效所带来的经济效益,以及中国庞大的人口基数所带来的市场需求,已经引起了全世界研究者和公司的极大热情和兴趣。


