北京工业大学曹楷/袁卿团队《ACS Nano》:探索纳米金团簇在缓解炎症性肠病和结肠癌发生中的潜在作用和分子机制
时间:2023-09-18 17:07:20 热度:37.1℃ 作者:网络
炎症性肠病与结直肠癌
炎症性肠病(IBD)是一种由过度胃肠道免疫反应引起的自身免疫性疾病,其特征是粘膜损伤和复发性溃疡,导致溃疡性结肠炎(UC)和克罗恩病(CD)。流行病学研究表明,超过20%的IBD患者容易发展为慢性肠炎相关的结直肠癌(CAC),这占IBD患者死亡的10%至15%。临床数据显示,由于生活方式和饮食结构的变化,IBD和CAC的患病率在过去几十年中迅速增加。因此,开发有效的IBD治疗策略对治疗疾病本身和CAC都是有益的。
巨噬细胞与炎症性肠病
巨噬细胞通过其不同的亚群在炎性肠病的发生发展过程中起着至关重要的作用。其中,M1巨噬细胞是促炎亚群,分泌多种炎症介质促进炎症产生;而M2巨噬细胞在IBD的消退期占主导地位,通过表达抗炎介质显著抑制炎症反应并促进组织修复。因此,重塑肠道环境中M1/M2亚群的平衡被广泛认为是IBD治疗的一种有效且有前景的策略。
金纳米团簇的免疫调节活性
北京工业大学高学云教授团队一直致力于研究金纳米团簇在重大疾病诊断和治疗方面的应用潜力。金纳米团簇具有良好的体内安全性和本征的生物医学活性,在多种免疫性疾病的治疗中显示了优异的应用潜力。
2023年9月14日,北京工业大学高学云教授课题组的袁卿副研究员和曹楷助理研究员团队在《ACS NANO》杂志 (IF=17.10) 在线发表了题为“Colon-accumulated gold nanoclusters alleviate intestinal inflammation and prevent secondary colorectal carcinogenesis via Nrf2-dependent macrophage reprogramming”的工作。该研究揭示了多肽金纳米团簇药物GA可以促进IL-4诱导的M2巨噬细胞分化,而且在促炎环境中也可以直接重编程腹膜巨噬细胞从M1极化向M2极化转变。进一步研究发现,这种调节作用是通过激活抗氧化Nrf2信号通路介导的,而不是传统的STAT6通路。特别的,在IBD模型中GA会特异性的积聚在IBD炎性结肠组织中,并通过Nrf2调节M2分化,发挥显著的抗炎治疗作用。最值得关注的是,GA治疗能显著抑制AOM/DSS诱导的CAC。这项研究为金属纳米药物治疗IBD和CAC提供了新的思路和理论参考。

【文章要点】
在本研究中,作者首先合成了以GSH为配体的金纳米团簇GA,并探究了GA在结肠炎病理状态下的体内分布。结果发现GA在炎性肠道有明显的聚集,在其他器官则无此现象。因此,GA可以特异性的聚集到小鼠的炎性肠道组织中。

图1. GA可以特异性地积聚在IBD小鼠的结肠中
巨噬细胞在肠炎的发生发展过程中发挥重要作用。前期主要是M1型细胞诱导炎性的产生(IL-6,IL-1β),在后期的组织修复阶段,巨噬细胞又分化成M2型抑制炎症反应(IL-10,Arg1)。作者从小鼠腹腔中提取巨噬细胞将其进行定向分化,发现GA可以显著促进M2型分化。更重要的是,作者发现即使在M1分化环境中,GA也促进了细胞从M1到M2的转化。
机制方面,作者发现GA并不能影响传统M2分化调节分子STAT6的活性。Nrf2是调节M2巨噬细胞分化的另一个重要蛋白。免疫荧光结果显示,GA可以在多种巨噬细胞极化情境中,显著促进Nrf2的入核。而抑制Nrf2的入核会消除GA促进M2巨噬细胞极化的功能,说明GA是通过激活Nrf2信号通路来调节巨噬细胞的M2极化过程。
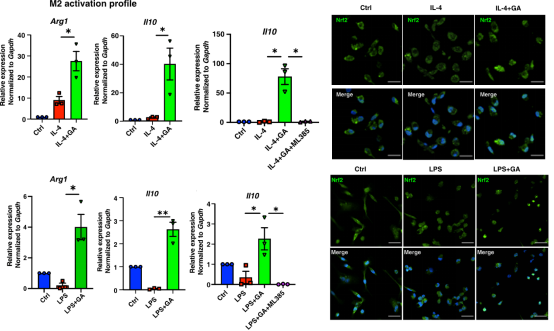
图2. GA可以促进依赖于Nrf2的M2巨噬细胞分化。
接下来作者建立了小鼠IBD模型来进一步评估GA的体内治疗潜力,发现GA可以显著的恢复DSS诱导的小鼠体重下降和结肠退化。通过分析小鼠肛门状态、粪便情况等对小鼠疾病状况进行打分,发现GA可以显著缓解疾病的严重程度。结肠组织的HE染色病理观察结果也证实GA具有很强的体内治疗作用。
体内机制分析发现, GA可以显著抑制肠道中M1型巨噬细胞的比例,促进M2型巨噬细胞的浸润。基因转录和蛋白质表达检测均证明GA可以显著抑制肠道中M1型巨噬细胞的细胞因子水平,而M2型巨噬细胞的细胞因子显著增加。
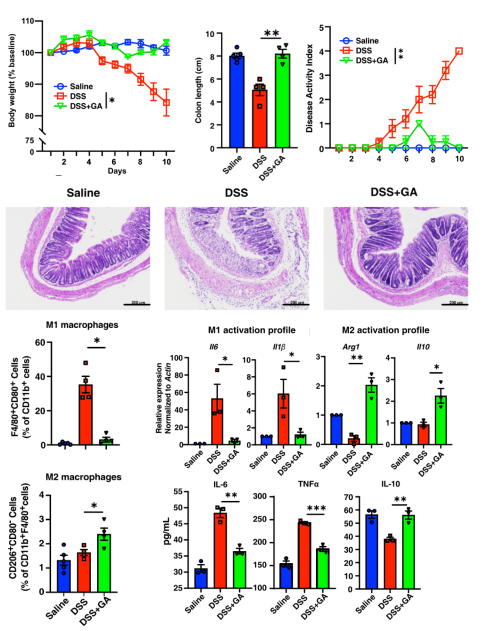
图3. GA通过调节M1/M2分化治疗IBD
为了研究GA的体内调节作用是否也依赖于Nrf2,作者检查了Nrf2的表达情况,发现磷酸化的Nrf2(p-Nrf2)在肠道中的表达显著提高。为了进一步确定Nrf2的作用,作者采用了Nrf2的抑制剂ML385,发现基本消除了GA的治疗作用。以上证据表明,纳米药物GA通过调节Nrf2通路来诱导巨噬细胞向M2型抑炎表型分化,从而缓解IBD。
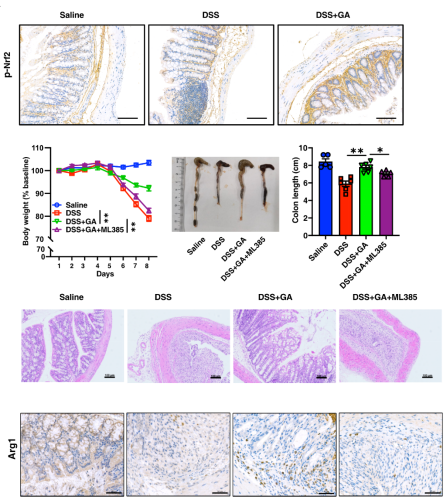
图4. GA通过Nrf2调节IBD期间的巨噬细胞极化。
既然GA可以治疗IBD,那么作者想进一步探究GA能否缓解IBD诱导的原发性结直肠癌的发生。据此,作者构建了AOM/DSS诱导的结肠癌小鼠模型。在此模型中,GA治疗组肿瘤灶数量明显减少,平均肿瘤体积也显著降低。因此证实纳米药物GA也能够有效抑制肠炎诱导的结肠癌的发生。
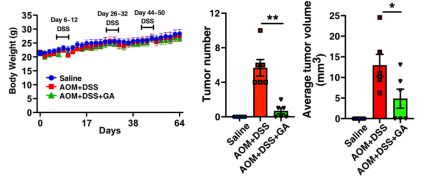
图5.GA可以缓解AOM/DSS 诱导的肿瘤发生。
【结论与展望】
作者最后总结,合成的金纳米团簇GA可以在炎性情况下显著聚集到肠道组织中,有效的将M1型促炎巨噬细胞以Nrf2依赖的形式转化成M2型抗炎巨噬细胞。通过这种转化重编程作用可以显著抑制肠道炎症,缓解IBD病理,并防止结直肠癌的发生。这些发现不仅揭示了金纳米团簇的新靶点,而且支持了纳米团簇类分子作为治疗炎性疾病的潜在策略的可行性。
北京工业大学袁卿副研究员和曹楷助理研究员为该论文的共同通讯作者,博士生陆草为本论文的第一作者。本研究受到国家重点研发计划,国家自然科学基金和北京市自然科学基金等项目资助。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c06025


