J Periodontol:牙龈源性间充质干细胞在实验性大鼠牙周炎中的局部应用
时间:2023-10-15 17:34:56 热度:37.1℃ 作者:网络
牙周病的常规治疗侧重于通过减少牙周组织中的微生物负荷和炎症来阻止疾病进展。虽然这些治疗方法减少了牙袋的深度并控制了感染,但对受损的牙骨质和牙槽骨进行了最小程度的修复。虽然牙周附着体的愈合可以长期维持,但这种愈合不能被认为是牙周组织的再生。适当的细胞群、信号分子和基质支架在时间和空间上有序和程序化的进展在牙周再生中起着关键作用。

组织工程和干细胞研究已经成为克服传统治疗方法局限性的替代方法,通过重建活的和功能的牙齿结构。干细胞可以从许多不同的来源获得,包括口外和口内组织。间充质干细胞是细胞再生疗法中应用最广泛的细胞,具有自我更新和分化为多种细胞系的潜力。骨髓间充质干细胞是多能基质细胞,具有分化为各种细胞类型的能力,包括成骨细胞、脂肪细胞和软骨细胞。虽然间充质干细胞的主要来源是骨髓,但它们也可以从其他来源获得,如脐带血、胎盘、羊水、脂肪组织、牙齿、牙龈、牙周韧带(PDL)、牙髓、牙滤泡。来自不同组织的间充质干细胞具有某些共同特征。然而,就分化潜力和功能特性而言,它们可能根据其起源的组织类型而有所不同。近年来,来自口腔组织的间充质干细胞因其独特的发育来源、相对较快的增殖速度和基因组稳定性,在再生医学领域受到越来越多的关注。
Zhang等人于2009年首次从牙龈组织中获得干细胞。基于2009年至今对GMSCs的研究,这些细胞被认为具有作为间充质干细胞来源的潜力,因为它们资源丰富,易于获取,并且易于通过微创手术获得。牙龈组织是一个容易获得干细胞的来源,因为在拔牙、冠延长、牙龈切除术、牙龈成形术和其他牙周外科手术过程中,牙龈组织经常被切除。GMSCs可以从正常或无炎症、附着或增生的牙龈中分离出来; 90%的GMSCs来自颅神经嵴细胞,其余10%来自间充质。GMSCs具有明显的抗炎和免疫调节作用。此外,GMSCs表现出稳定的形态,并且在更高的传代中不会失去其MSC特性。GMSCs在长期培养中保持正常的核型和端粒酶活性,并且不致瘤。近年来研究报道,GMSCs抑制T淋巴细胞的增殖和活化,对多种先天免疫细胞,特别是巨噬细胞、肥大细胞和树突状细胞具有强大的免疫调节功能。为了实现丢失组织的再生,模拟细胞外基质的人工环境(支架)提供细胞的存活、增殖和分化,是组织工程的关键。水凝胶形成亲水网络,通过模拟天然细胞外基质促进再生。丝素蛋白(F)是一种具有再生特性的蛋白型生物材料,可用于干细胞包封。据报道,在透明质酸水凝胶中掺入丝蛋白可提高体外培养的人牙髓干细胞的细胞活力和成牙分化。
壳聚糖乳酸(COS)是壳聚糖的降解形式,是一种从昆虫外骨骼和真菌细胞壁中提取的低聚糖。据报道,COS可以防止甲基丙烯酸酯基牙科材料对人牙龈成纤维细胞的遗传毒性作用。COS也被认为是一种免疫调节生物材料。据报道,COS在体外可降低Raw 264.7巨噬细胞的一氧化氮释放和THP-1单核细胞的NFκB表达。干细胞作为目前牙周病的临床治疗方法之一的出现,使得有必要确定容易获得和安全的干细胞群,这些干细胞群具有分化成牙周组织再生所需的细胞类型的能力。本研究旨在探讨纤维蛋白/壳聚糖水凝胶(F/COS)局部应用龈源性间充质干细胞(GMSC)对实验性牙周炎大鼠牙周组织愈合的影响。

图1 (A)制作固定大鼠的定制口腔牵开器,(B)缝合后2周的临床表现,(C) 2周后形成的牙周缺损临床表现,(D,E)使用CTVox (Skyscan 1272, Bruker x线,比利时)重建的三维显微ct图像。在14天结束时,在牙齿周围放置丝缝合线导致明显的骨质流失。(D) H组;(E) P组第2周;(F)红点为测点;(G,H)红线表示从腭ABC到CEJ的距离,在横切面和矢状面作为牙槽骨丢失(ABL)的标志。
方法:从大鼠牙龈中分离间充质干细胞并进行鉴定。对水凝胶中的GMSC进行了活力测试和共聚焦成像。无牙周炎的健康控制(卫生;H;n=10),对照组牙周炎但不应用(牙周炎;P;n=10),仅水凝胶应用(F/COS;n=10), GMSC+F/COS (n=10)四组进行体内研究。在上颌第二磨牙周围用丝线缝合形成实验性牙周炎。用F/COS中绿色荧光蛋白(GFP)标记的GMSC (250000 cells/50 μL)处理缺陷。于第2周和第8周处死动物,采用显微ct (micro-CT)和组织学方法对动物上颌部进行观察。在8周结束时确认GFP标记的GMSC的存在。
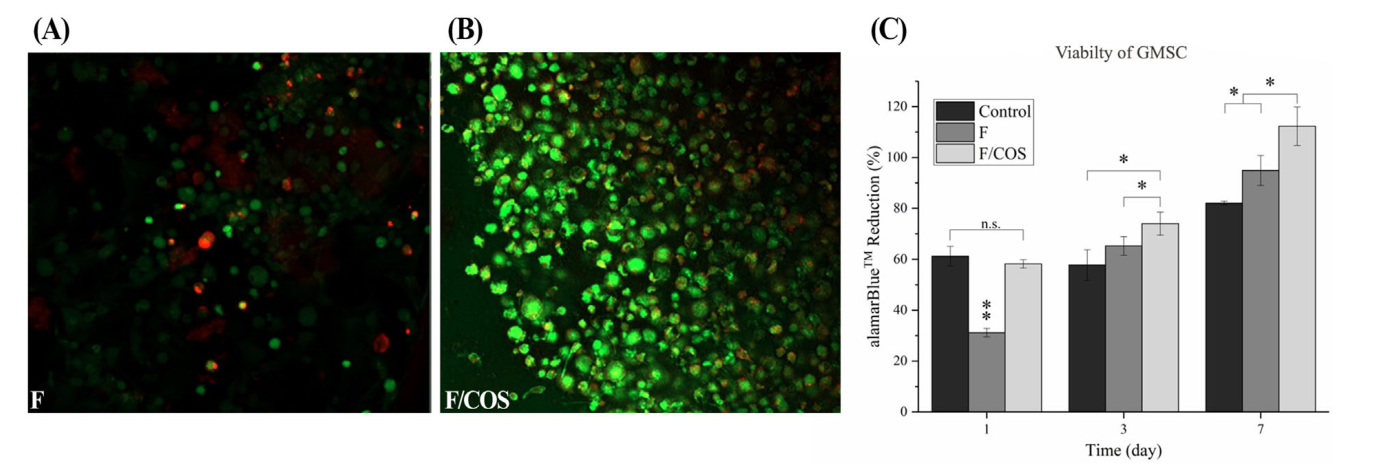
图2 (A,B)培养7天后F和F/COS水凝胶包封gfp标记的大鼠GMSCs的共聚焦图像(C)将大鼠GMSCs接种于组织培养聚苯乙烯(TCPS)并包封于F和F/COS水凝胶后Alamar Blue减少百分比(n = 6, p < 0.05)。
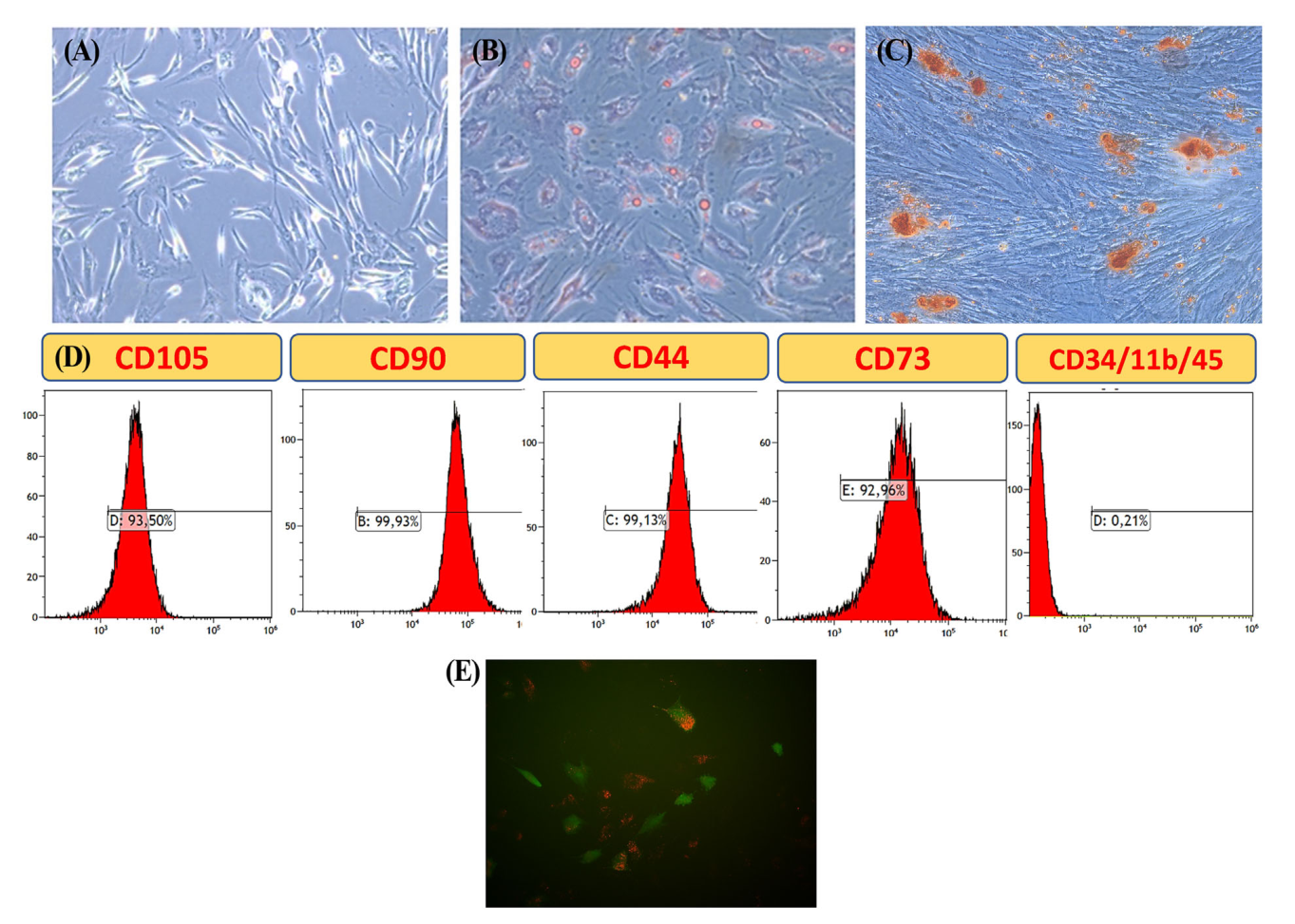
图3 GMSCs和gfp - pkh26标记的GMSCs的表征。(A)转基因干细胞的形态学。(B)诱导成脂后观察到脂滴。(C)茜素红染色后可见钙沉积。(D)流式细胞术结果显示,msc特异性表面标记物在GMSCs中呈阳性表达。(E)转染GFP后,用PKH26膜染料对GMSCs进行染色。染色后,用共聚焦显微镜对GFP转染的GMSCs和PKH26阳性的GMSCs进行成像。
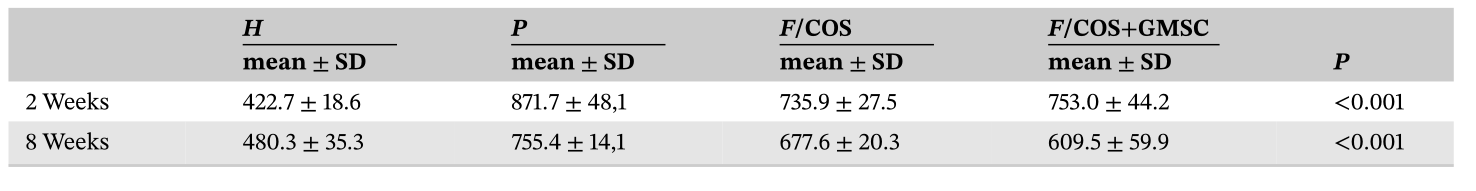
表1 各组移植后2、8周CEJ-ABC水平(平均±SD;μm)
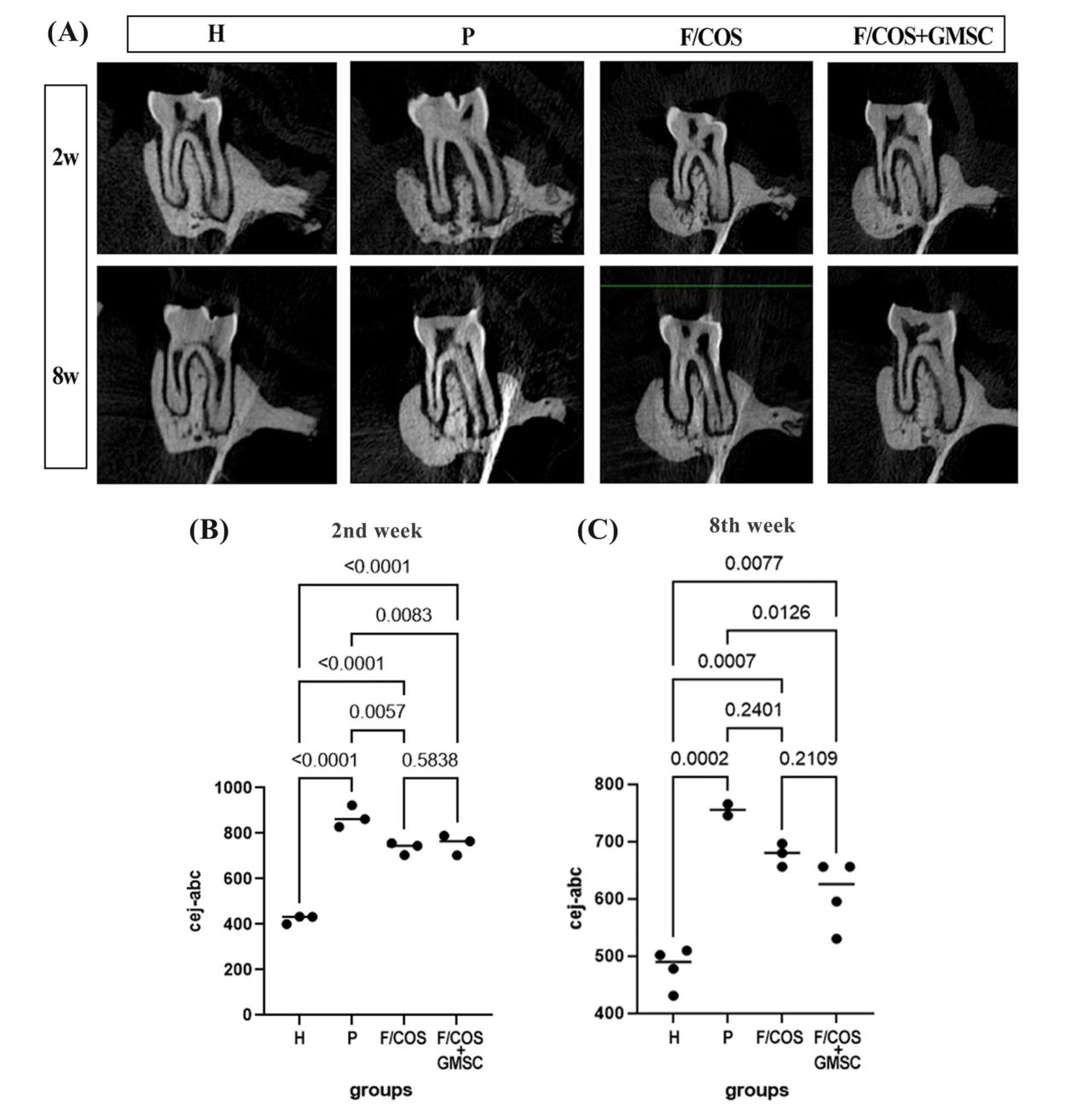
表4 牙槽骨丢失的显微ct分析。(A)各组横切面2、8周变化的代表性显微ct图像。(B, C) P组CEJ-ABC水平最高,表明移植后第2周骨吸收严重。第2周时,F/COS组和F/COS+GMKH组骨损失明显小于P组。8周时,P、F/COS、F/COS+GMKH组骨均有所增加。第8周时,F/COS+GMSC组ABL明显低于P组。与P组相比,F/COS组的ABL也较低,但在第8周时差异不显著。*P < 0.05为差异有统计学意义。
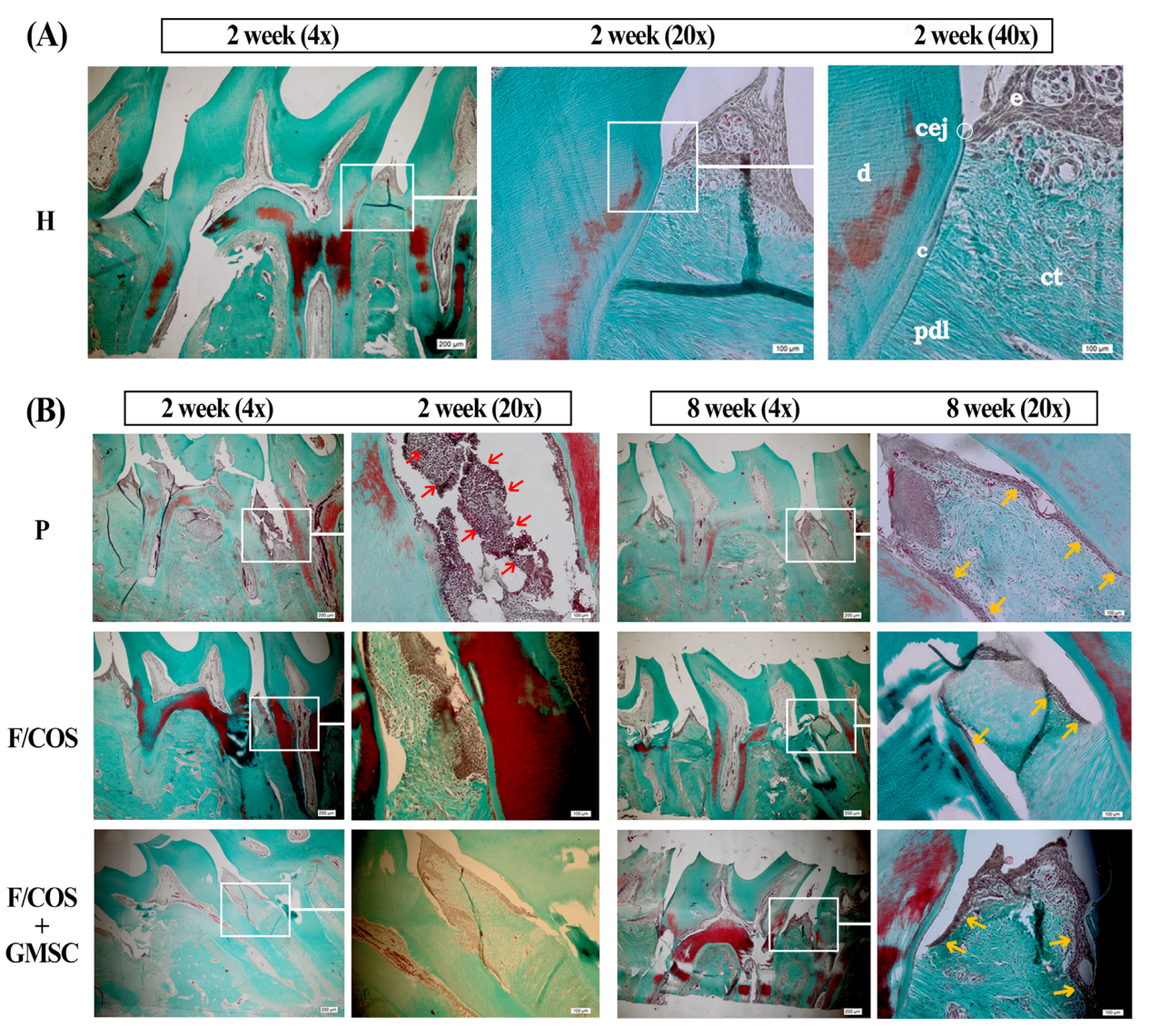
图5 马松三色染色后大鼠第一、第二磨牙间区域横切面的相衬图。(A)健康组第2周。cej:牙骨质-牙釉质交界处,e:上皮,d:牙本质,c:骨水泥,ct:结缔组织,pdl:牙周韧带(B)移植后第2周,P组出现严重的牙周炎症和牙周组织破坏(红箭头)。F/COS组和F/COS+GMSC组炎症和组织破坏较少。所有牙周炎诱导组(P组、F/COS组、F/COS+GMSC组)均出现牙间乳头缺失和结界上皮的根尖迁移(黄色箭头)。在第8周的切片中,与P和F/COS组相比,F/COS+GMSC组的连接上皮的顶端迁移较少。马松三色染色法;放大:×4。比例尺,200 μm,放大倍数:×20, ×40。标尺,100 μm)。
结果:Micro-CT分析显示,8周结束时,F/COS+GMSC治疗组与P组相比,新骨形成有统计学意义(P < 0.05)。F/COS组也有新生骨形成,但与P组比较差异无统计学意义(P > 0.05)。与P组相比,F/COS+GMSC组长结上皮的形成较少。F/COS+GMSC组牙周韧带和结缔组织组织良好。
结论:水凝胶局部应用GMSC可促进实验性牙周炎大鼠新牙周韧带和牙槽骨的形成。由于牙龈是一种易接近的组织,因此自体细胞治疗在临床应用中具有广阔的前景。
原始出处:
Balaban YE, Akbaba S, Bozkurt SB,Local application of gingiva-derived mesenchymal stem cells on experimental periodontitis in rats.J Periodontol 2023 Oct 03;


