Nature Communications:警惕!牙疼恐引发严重疾病!首医团队最新研究,从国自然热点切入
时间:2024-07-01 10:00:38 热度:37.1℃ 作者:网络
牙疼不是病,疼起来真要命。很多人年纪轻轻就开始牙疼,但是有的时候没有时间及时就诊。殊不知,牙疼不只是疼痛那么简单,还能引发其他疾病。
已有研究表明,牙周炎与炎症性肠病(IBD)密切相关,这两种疾病的特征是对非生态共生微生物组的过度和非自限性免疫反应。然而,重叠的潜在机制仍需阐明。
近日,首都医科大学研究团队在 Nature Communications 杂志发表研究成果,该研究揭示了牙周炎致病菌牙龈卟啉单胞菌(Pg)通过肠道菌群依赖的方式加重肠道炎症和Th17/Treg细胞失衡,为伴牙周炎的炎症性肠病(IBD)患者提供了新的干预疗法。

一、研究内容与思路
1、Pg灌胃加重结肠炎
作者首先探讨了牙周炎是否会影响结肠炎,给DSS诱导的结肠炎小鼠Pg(牙龈卟啉单胞菌)或pg提取物灌胃处理,结果发现二者均会加重结肠炎,此外,pg灌胃(DSS+LiPg)小鼠的炎症程度比pg提取物灌胃(DSS+DePg)小鼠更严重,提示结肠炎症程度与Pg活性密切相关。
进一步分析Treg/Th17细胞情况,发现DSS+LiPg组和DSS+DePg组Th17细胞百分比显著高于DSS+ PBS组,而DSS+LiPg组和DSS+DePg组Treg细胞百分比显著低于DSS+ PBS组。DSS+LiPg组和DSS+DePg组大鼠MLN(肠系膜淋巴结)和LPL(固有层淋巴细胞)中Th17/Treg细胞比例显著高于DSS+ PBS组,说明Pg灌胃对结肠炎的加重很好地反映在Th17/Treg细胞失衡上。
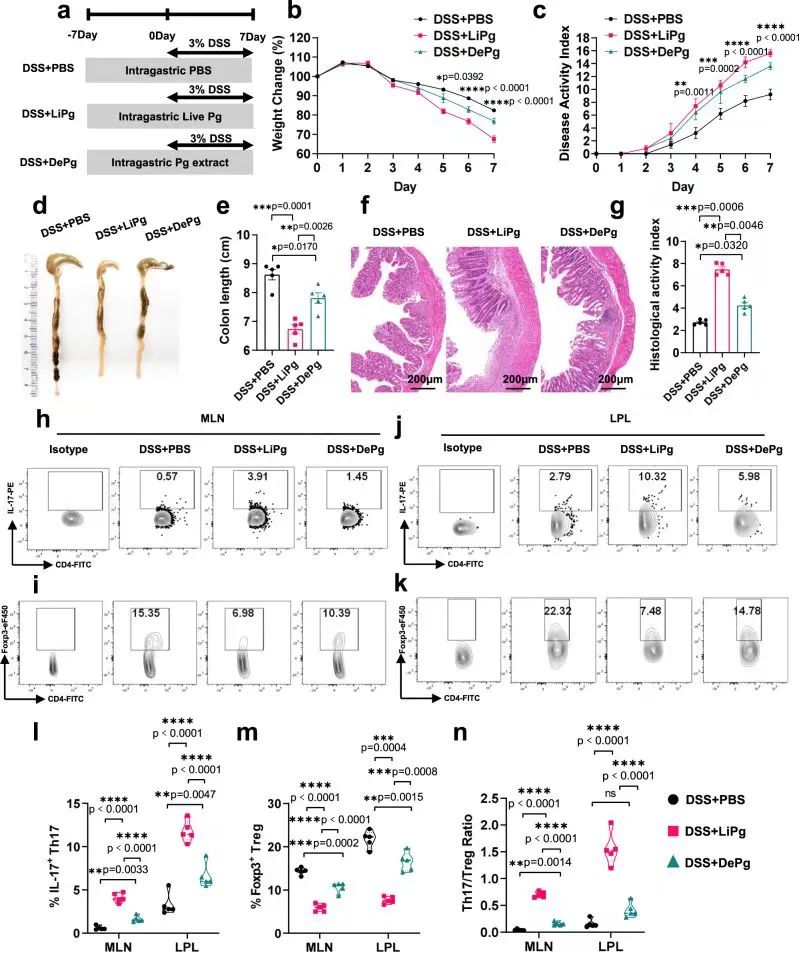
研究思路1:作者文献阅读发现牙周炎与炎症性肠病(IBD)密切相关,对此,作者选择了炎症性肠病中的结肠炎开展研究,探讨牙周炎是否会加重结肠炎。
牙周炎是由Pg导致的,作者首先给结肠炎小鼠Pg处理来探讨二者的联系,发现牙周炎会加重结肠炎,且与Th17/Treg细胞失衡相关。
2、灌胃Pg以肠道菌群依赖的方式加剧结肠炎和Th17/Treg细胞失衡
作者探讨了Pg灌胃导致结肠炎的加重是由于Pg本身的毒性还是肠道菌群的调控。给予小鼠四种抗生素混合物以消耗肠道菌群,之后采用DSS构建结肠炎小鼠模型,结果发现DSS+LiPg组和DSS+DePg组的结肠炎均未加重,Th17和Treg细胞的百分比以及Th17/Treg细胞的比例均无统计学差异,表明Pg灌胃引起结肠炎小鼠结肠炎症加重和Th17/Treg细胞失衡可能与肠道菌群直接相关。
进一步,作者用上述3种不同处理小鼠的肠道微生物群重建受体小鼠(GDR小鼠),结果发现DSS+LiPg组和DSS+DePg组小鼠的炎症程度比DSS+ PBS组小鼠更严重,结肠炎表现更显著,直接证实了结肠炎的加重是由肠道菌群介导的,而不是Pg本身毒性导致的。
DSS+LiPg组和DSS+DePg组Th17细胞百分比显著高于DSS+ PBS组,而DSS+LiPg组和DSS+DePg组Treg细胞百分比显著低于DSS+ PBS组,表明小鼠结肠局部Th17/Treg细胞失衡同样依赖于肠道菌群。
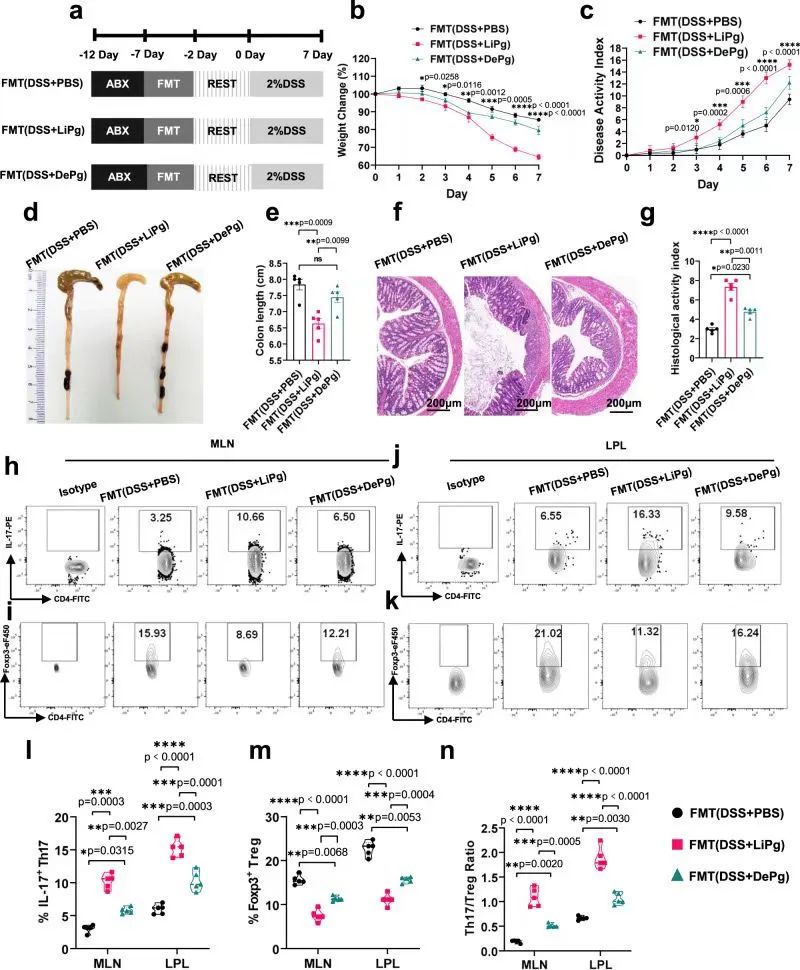
研究思路2:明确Pg加重结肠炎后,究竟是Pg直接导致还是Pg+肠道菌群变化而导致的?结果发现,Pg引起肠道菌群变化,从而影响结肠炎。
3、灌胃Pg改变了肠道菌群的组成
作者采用宏基因组测序来分析小鼠肠道微生物变化情况,结果发现DSS+LiPg组和DSS+PBS组的共有物种数量明显少于DSS+DePg组和DSS+PBS组,灌胃活Pg后肠道菌群的变化比灌胃Pg提取物更为明显,这与DSS+LiPg组存在更严重的结肠炎症结果相一致。进一步分析发现,Pg灌胃后的菌群多样性更高,但与DSS+PBS组相比,DSS+LiPg组物种组成结构上的相似性低于DSS+DePg组。
物种组成分析显示:丰度最高的前4个细菌门分别是拟杆菌门、厚壁菌门、疣微菌门和放线菌门。其中,DSS +LiPg小鼠的拟杆菌门丰度增加,而厚壁菌门、疣微菌门和放线菌门丰度降低。进一步分析发现,Pg灌胃后拟杆菌门丰度的增加或厚壁菌门的降低均与结肠炎的加重呈正相关。
综上所述,DSS+LiPg组和DSS+DePg组结肠炎较DSS+PBS组更为严重的原因可能是肠道菌群组成不平衡,主要表现为拟杆菌门丰度增加和厚壁菌门丰度减少。
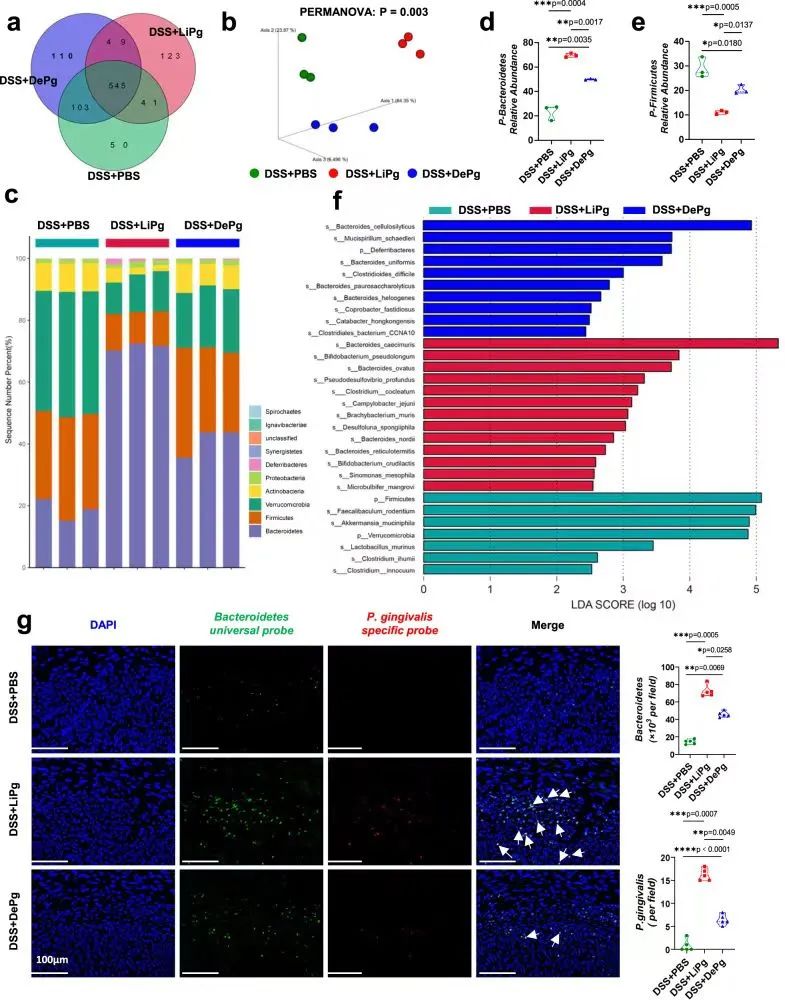
研究思路3:既然涉及到肠道菌群了,肯定要测序来探讨是哪些肠道菌群发生了变化,以及具体菌群会带来什么影响。
4、亚油酸(LA)是结肠炎小鼠饲粮中Pg的关键肠道代谢物,可促进Th17/Treg细胞失衡
已有研究发现,拟杆菌门的所有成员都表达与对长链脂肪酸的代谢至关重要的AfAas2,而厚壁菌门的乳酸杆菌属可产生多种脂肪酸。对此,作者分析了三组小鼠粪便样本代谢组学,发现各组之间存在显著不同的代谢物。
通路富集分析发现三组间LA代谢途径差异最为显著。聚类热图分析显示,与DSS+PBS组相比,DSS+LiPg和DSS+DePg组对LA有明显的抑制作用。而不管有无清除肠道菌群,LA灌胃均可以改善结肠炎小鼠。这一结果表明Pg灌胃导致肠道菌群代谢产物LA水平下降,进而加重结肠炎,说明LA是肠道菌群代谢的最终产物。此外,LA灌胃后,Th17细胞表达减少,Treg细胞表达增加,Th17/Treg细胞失衡得以纠正。
综上所述,LA是Pg灌胃后加重结肠炎和Th17/Treg细胞失衡的最终代谢产物,Pg通过干扰肠道菌群组成及其代谢,加重结肠免疫失衡。
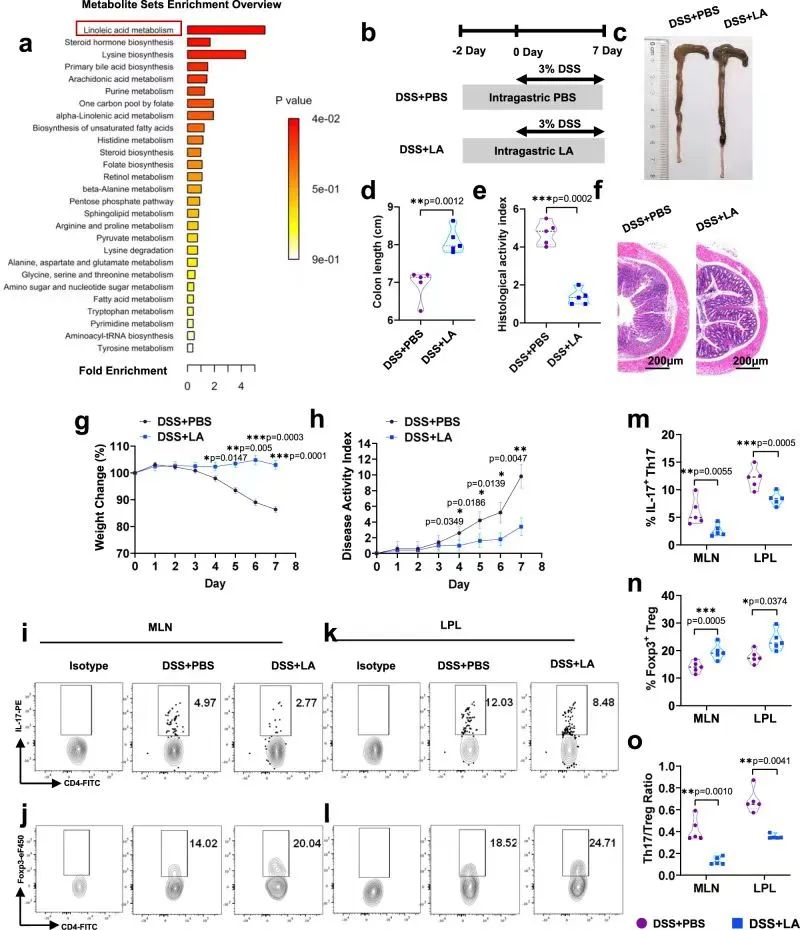
研究思路4:发现了菌群变化后,从菌群入手,菌群又涉及到代谢,因此作者从代谢入手,有涉及到代谢组学测序,去探讨是什么代谢产物发生变化。代谢组学发现了LA后开展实验验证LA是否的确发挥重要作用。
5、LA抑制Th17细胞分化、促进Treg细胞分化
作者探讨了LA是否直接影响Th17和Treg细胞分化。体外实验发现在CD4+T细胞中,当LA浓度达到50 μM及以上时,IL-17的表达被抑制,Foxp3表达增加,表明LA可以抑制Th17的分化,促进Treg细胞增殖。
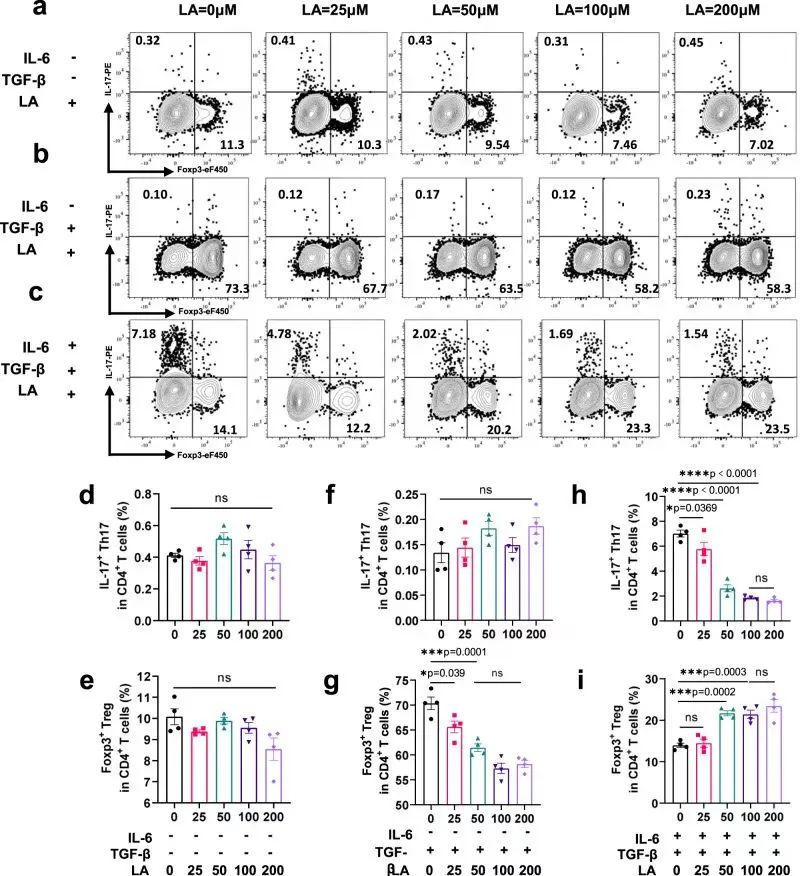
研究思路5:体内发现LA有助于改善Th17/Treg细胞失衡。对此,作者简单开展了体外实验来探讨LA在体外对Th117/Treg细胞的影响。
6、LA通过AHR调节Stat1激活以抑制Th17细胞的分化,促进Treg细胞增殖
作者对三组样本宏基因组数据进行LEfSe分析以便寻找LA调节Th17/Treg细胞平衡的可能靶点,发现HSP90A(热休克蛋白90 α)和AHR(芳基烃受体)复合物是DSS+LiPg组在Th17分化信号通路中的特征基因生物标志物。进一步检测HSP90A和AHR变化,发现LA与AHR结合后,HSP90和AHR复合物解离,然后AHR进入细胞核。
进一步,作者RT-qPCR和WB检测小鼠肠道组织发现LA促进了Stat1和Stat5的表达,抑制了Stat3的表达。体外实验结果与体内实验结果一致:LA通过特异性结合AHR作为拮抗剂,驱动Stat1在Ser727位点的磷酸化,从而抑制IL-17,增强Foxp3的表达。
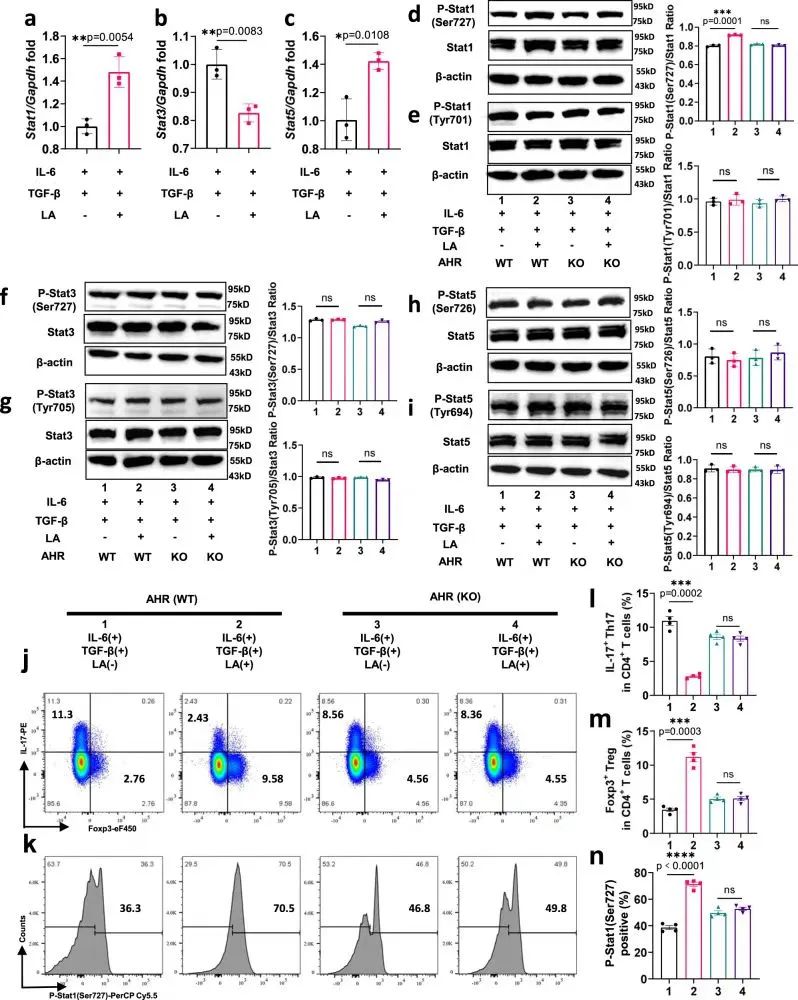
研究思路6:明确了LA调节Th17/Treg细胞失衡,那LA如何发挥影响,涉及到了LA作用机制。
7、补充LA以AHR依赖性方式缓解了Pg诱导的结肠炎和Th17/Treg细胞失衡
作者在结肠炎构模前7天的时候给予WT或AHR−/−小鼠灌胃新鲜Pg或Pg+LA,直至成功造模。之后处死小鼠,发现WT (DSS+Pg+LA)小鼠结肠炎得到缓解。相比于WT (DSS+Pg+LA)组小鼠,WT (DSS+Pg)组小鼠,Th17/Treg细胞失衡显著,结肠炎表现更明显,表明LA可以恢复Th17/Treg细胞失衡。AHR−/−(DSS+Pg)组和AHR−/−(DSS+Pg+LA)组小鼠结肠炎相关表现没有显著差异、Th17/Treg细胞失衡没有发生变化,表明AHR缺乏条件下补充LA对结肠炎没有改善作用。
综上所述,该研究表明LA在体内以AHR依赖的方式减轻Pg引起的结肠炎加重和Th17/Treg细胞失衡。
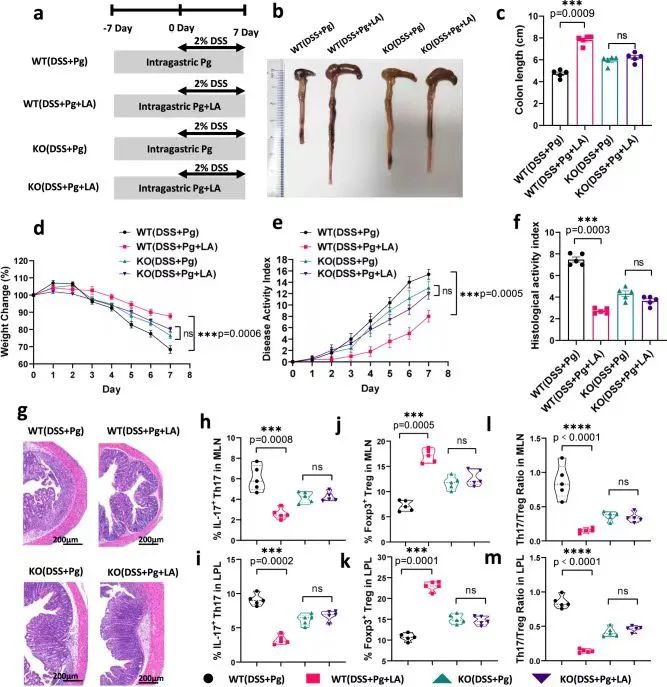
研究思路7:之前发现AHR可能在LA影响Pg介导的结肠炎及Th17/Treg细胞失衡发挥作用,对此,作者引入AHR基因敲除鼠去直接验证这一逻辑,发现AHR的确在LA发挥作用的时候必不可少。
二、小结
综合所有数据表明,牙周炎的关键致病菌Pg以肠道菌群依赖的方式加重结肠炎症,其潜在机制与肠道黏膜中Th17/Treg细胞平衡的改善有关,而肠道菌群代谢产物LA可以恢复Th17/Treg细胞平衡,从而改善Pg加重的结肠炎。进一步挖掘,发现这一环节与AHR相关。
这一研究结果揭示了Pg如何通过肠道菌群-LA代谢-Th17/Treg细胞平衡轴调节结肠炎,提供肠道炎症期间宿主与微生物群和肠道代谢之间相互作用的实际例子,突出了LA介导的免疫调节在预防生态失调和肠道炎症中的重要性。
参考文献:
[1]Jia, Lu et al. “Porphyromonas gingivalis aggravates colitis via a gut microbiota-linoleic acid metabolism-Th17/Treg cell balance axis.” Nature communications vol. 15,1 1617. 22 Feb. 2024, doi:10.1038/s41467-024-45473-y


