JAMA Netw Open:多中心队列研究揭示,RNA+DNA-NGS联合检测可提高晚期NSCLC患者SV检出率
时间:2024-11-12 12:04:53 热度:37.1℃ 作者:网络
在晚期非小细胞肺癌(NSCLC)中,与标准化疗相比,对携带特定结构变异(SV)的患者进行靶向治疗可提高生存率。因此,美国国立综合癌症网络(NCCN)NSCLC指南及相关临床专家建议对晚期NSCLC进行基因组检测,以确定可能从靶向治疗中获益的患者,包括ALK、RET、ROS1和NTRK1/2/3中的基因融合,以及MET外显子14跳跃改变。
在临床环境中,DNA-NGS广泛用于检测SV,但其在检测灵敏度和reads覆盖范围之间很难取得平衡,也很难确定最佳区域来识别与剪接事件相关的DNA变异,往往会导致临床可操作结构变异(aSV;融合和剪接变异)漏检。RNA-NGS通过直接观察基因融合和剪接接头,克服了DNA-NGS在SV检测中的局限性,有可能提高aSV靶点的检测率,但RNA-NGS在当前常规肿瘤临床护理中的应用十分有限。与仅使用DNA-NGS相比,RNA-NGS+DNA-NGS能否在晚期癌症患者中检测到更多aSV?
为此,华盛顿大学医学院科研团队及合作者在JAMA network open发表了题为“Actionable Structural Variant Detection via RNA-NGS and DNA-NGS in Patients With Advanced Non–Small Cell Lung Cancer”的文章。研究团队对5,570名接受RNA-NGS和DNA-NGS检测的晚期NSCLC患者进行队列研究,发现8.8%的患者通过一种或两种方法检测到至少1个aSV。与单独使用DNA-NGS相比,同时进行RNA-NGS和DNA-NGS检测到携带aSV的患者增加了15.3%。综上,临床上应同时使用RNA-NGS和DNA-NGS检测,以便最大限度地检出SV;RNA-NGS也应在晚期NSCLC患者的治疗中常规使用。

文章发表在JAMA network open
这项多中心、回顾性队列研究纳入了Tempus多模态数据库中5,570名患者,这些患者在2021年2月-2023年10月期间接受了基于组织的DNA-NGS和全转录组RNA-NGS检测;该数据库由链接的分子和临床数据组成,包含来自不同地域的肿瘤诊疗机构的纵向去标识化数据。该研究参与者为晚期(IIIb-IV期)肺腺癌患者,具有足够的实体瘤组织样本用于RNA-NGS和DNA-NGS检测。患者的中位年龄(IQR)为67.8(61.3-75.4)岁,53.7%为女性,70.5%是或曾是吸烟者。
1.SV的发生率
总体而言,研究团队在8.8%的患者中发现了符合NCCN推荐靶向治疗的aSV。ALK、RET和ROS1、NTRK1/2/3、MET外显子14跳跃等每种aSV的发生率分别为4.5%、1.1%、0.1%和2.1%(图1)。携带aSV的患者更倾向于是非吸烟者且更年轻,而其中携带MET外显子14跳跃变异的患者年龄较大。
表. 队列的临床和人口统计学特征(根据SV状态分层)。
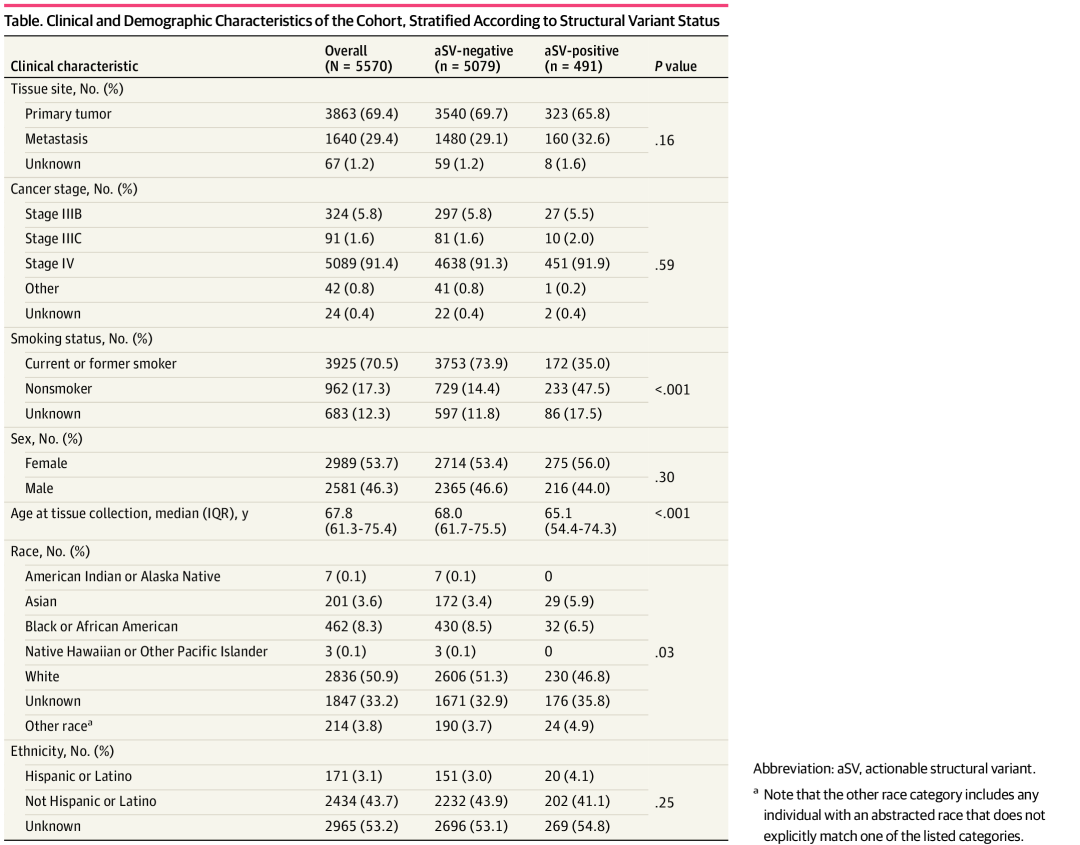
对于携带aSV的患者,RNA-NGS在13.2%的患者中唯一鉴定出了aSV。仅通过RNA-NGS而非DNA-NGS鉴定出的aSV的百分比因aSV而异,其中ROS1鉴定出的百分比最大(25.4%)(图1B)。总之,与仅使用DNA-NGS相比,在增加RNA-NGS后检测到携带aSV的患者多出15.3%(491vs426名患者),其中携带可操作融合的患者多出14.3%,携带MET外显子14跳跃变异的患者多出18.6%(图1C)。
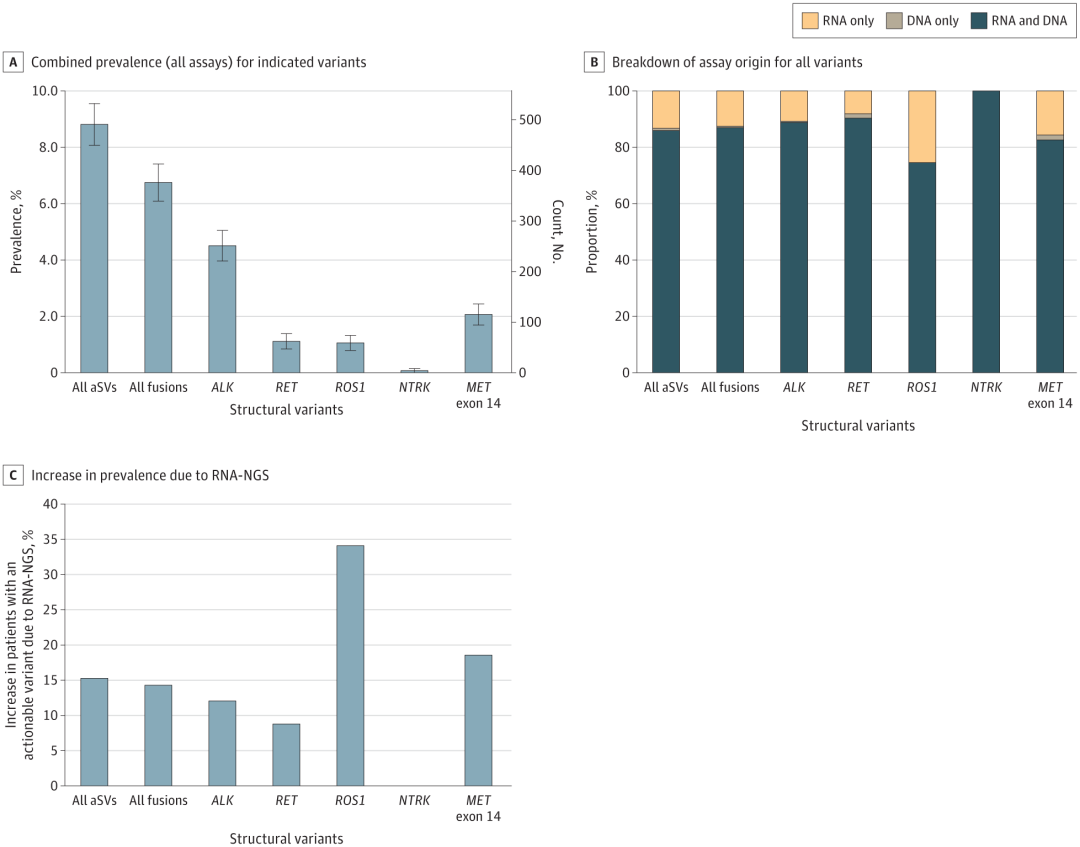
图1. 通过RNA-NGS和DNA-NGS联合检测aSV的评估。
2.RNA-NGS和DNA-NGS检测融合伙伴和融合异构体
每种融合检测到的最常见的融合伙伴侣分别是ALK-EML4、RET-KIF5B和ROS1-CD74;这些典型伙伴更可能被RNA-NGS检测到,而DNA-NG检测到的融合伙伴较为罕见。例如,通过RNA-NGS鉴定出的ALK融合患者中93.2%以EML4为主要伙伴,而在DNA-NGS鉴定出的ALK融合患者中有82.1%以EML4为主要伙伴。
研究团队对通过RNA-NGS和DNA-NGS均检测到融合的患者亚组(n=327)中进行分析并量化了融合伙伴的一致性(图2)。结果显示,大多数患者在两种检测中都检测到了相同的融合伙伴,其中NTRK和ROS1的一致性最高,ALK和RET的一致性最低。
对于每个融合基因最常见的融合伙伴,研究团队还根据检测方式额外评估了融合异构体的分布。对于ALK-EML4融合,仅通过RNA-NGS检测到的融合异构体与同时通过两种NGS方法检测到融合异构体在分布上存在差异;仅通过RNA-NGS检测到的EML4-Exon6+ALK-Eno20的频率更高。
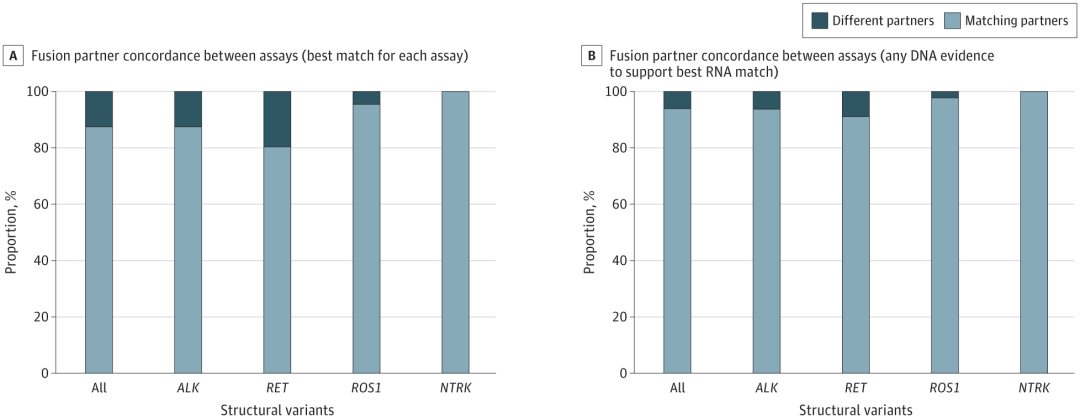
图2. RNA-NGS和DNA-NGS均检测到融合时的融合伴侣一致性。
3.通过RNA-NGS和DNA-NGS检测SV的靶向治疗
在检测到aSV的491名患者中,有104名在Tempus NGS测序时对靶向治疗不太了解,并具有纵向药物信息(图3)。上述104名患者中,84名(80.8%)在测序后接受了NCCN推荐的、针对已确定aSV的匹配靶向治疗,采用率因SV而异;未接受匹配治疗的患者(n=20)接受了联合化疗和免疫治疗。
研究团队评估了用于检测aSV的检测方法与靶向治疗采用率之间的关系。结果显示,通过DNA-NGS检测出变异的患者的治疗采用率高于仅用RNA-NGS检测到变异的患者,但这些比率在总体或特定aSV上无显著差异。因此,用于检测aSV的检测方法与采用aSV靶向治疗或临床结果之间没有明显关联。
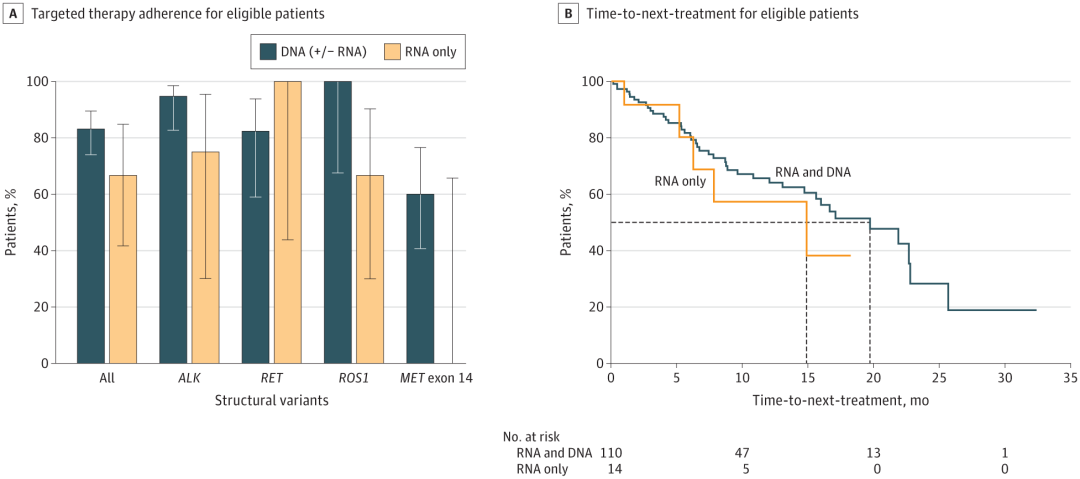
图3. 根据检测方式对具有丰富临床数据的患者亚组进行治疗实施和下次治疗时间分层。
此外,研究团队还评估了与仅RNA-NGS检测相比,同时通过RNA-NGS和DNA-NGS检测并接受靶向治疗的aSV患者的下一次治疗时间(TTNT,即多中心无进展生存的替代终点)是否存在差异;选择124名患者进行TTNT评估,其中14名患者仅通过RNA-NGS检测到变异。结果显示,两组患者的TTNT无明显差异;同时通过RNA-NGS和DNA-NGS检测患者的中位TTNT为19.7个月,而仅通过RNA-NGS检测患者的中位TTNT为14.9 个月。
4.eSV生物标志物在NSCLC中的评估
研究团队检测了BRAF、NRG1、EGFR和FGFR2/3融合的新兴结构变异(eSV)(图4A)。结果显示,在研究队列中,eSV总体发生率为0.7%:BRAF为0.3%,NRG为10.2%,EGFR为0.1%,FGFR2/3为0.1%;除FGFR3(其所有融合伙伴均为TACC3)外,未发现任何驱动因子融合的显性融合伴侣。53%的eSV仅通过RNA-NGS检测到;与仅使用DNA-NGS相比,增加RNA-NGS检测后eSV检出率增加了一倍多(110.5%的增加)。
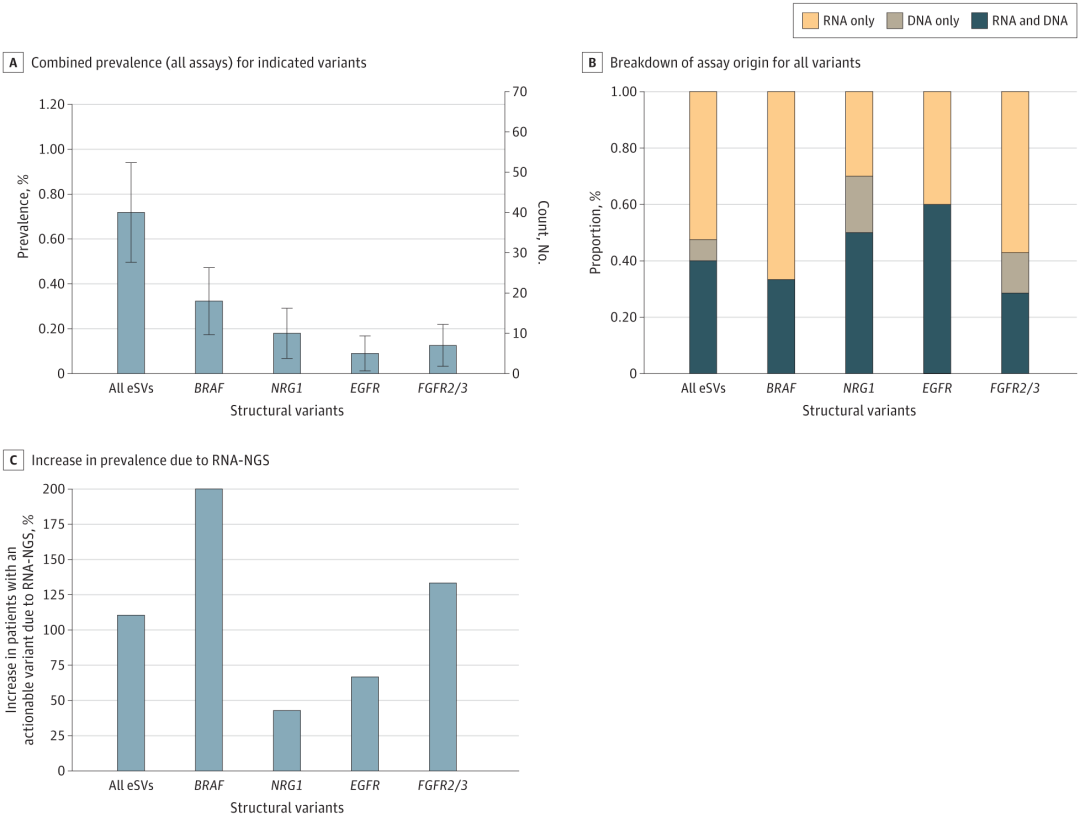
图4. 通过RNA-NGS和DNA-NGS联合评估新出现的融合变异。
该研究作者表示:“这些发现支持对前期双变异靶向治疗进行可能的评估,以减轻耐药机制。不过,需要进一步的前瞻性临床研究来验证这些发现,并应考虑在未来的注册研究中纳入RNA-NGS作为辅助诊断检测。”
综上所述,该研究是扩大支持NCCN指南建议在NSCLC中同时使用RNA-NGS和DNA-NGS临床证据的最大规模回顾性研究。该研究表明,RNA-NGS具有强大的临床敏感性,当与DNA-NGS结合用于现有和新兴可操作结构变异时,可显著增强检测,并且应在临床上常规提供DNA-NGS,以最大限度地提高晚期腺癌NSCLC患者的SV检出率。
参考文献:
1.Dwight Owen, MD, MS1; Rotem Ben-Shachar, PhD2; Josephine Feliciano, MD3; et al. Actionable Structural Variant Detection via RNA-NGS and DNA-NGS in Patients With Advanced Non–Small Cell Lung Cancer.JAMA Netw Open. 2024;7(11):e2442970.
2.https://jamanetwork.com/journals/jamanetworkopen/fullarticle/282562
3.Lung Cancer Study Suggests Concurrent RNA, DNA Testing Picks up Actionable SVs
4.https://www.genomeweb.com/cancer/lung-cancer-study-suggests-concurrent-rna-dna-testing-picks-actionable-svs


