Adv Mater:浙江大学毛峥伟团队开发纳米酶修饰噬菌体系统,通过微环境响应高效对抗细菌感染
时间:2023-04-30 18:40:00 热度:37.1℃ 作者:网络
细菌感染是公共卫生面临的最大挑战之一,需要新的治疗方法。
2023年4月21日,浙江大学毛峥伟团队在Advanced Materials 在线发表题为“Microenvironment Activated Nanozymes-Armed Bacteriophages Efficiently Combat Bacterial Infection”的研究论文,该研究制备了一种新型纳米酶修饰噬菌体(phage@Pd)系统来对抗细菌感染。所提出的phage@Pd保留了噬菌体的功能,以实现对宿主大肠杆菌(E. coli)的精确识别和粘附。同时,具有显著pH依赖性、类过氧化物酶(POD)活性的超小钯(Pd)纳米酶可以在酸性和H2O2过表达的感染微环境中产生有毒的羟基自由基,且在生理条件下保持惰性,从而实现感染部位细菌的显著消除,确保phage@Pd在健康组织中的生物安全性。
phage@Pd的丝状结构还可以通过随机缠结在非宿主细菌上来提高其对非宿主细菌的杀菌效率,表明其潜在的广谱杀菌功效。值得注意的是,phage@Pd不仅可以根除浮游细菌,还可以在体外杀死生物膜内的细菌。急性细菌性肺炎或皮下脓肿的体内模型中,phage@Pd在消除感染和促进组织恢复方面显示出优异活性。结果表明,phage@Pd纳米杂化物是一种安全有效的抗菌剂,为抗菌材料的开发提供了新思路。

病原菌感染是一个重大的公共卫生挑战,困扰着数百万人,严重时可能致命。临床上,大剂量抗生素是治疗细菌感染的主要选择,其通过破坏细胞膜/细胞壁的形成、蛋白质的合成或DNA的复制/修复来达到目的。但耐药菌的出现缩小了抗生素的实际治疗窗口期。更糟糕的是,细菌可以形成生物膜,在感染周围形成物理和化学屏障,导致抗生素耐药性进一步增加两到三个数量级。尽管新类别的抗生素正在开发,但其受到审批速度和数量不断下降的阻碍。因此,开发新的抗菌方法势在必行。
噬菌体(phage)是其细菌宿主的专性捕食者,能够识别并寄生宿主细菌产生子代,最终导致细菌裂解。基于噬菌体诱导的细菌裂解过程不受细菌耐药性的影响,噬菌体疗法已被提议作为传统抗生素的替代方法。此外,噬菌体只会感染特定的病原体,而不会破坏正常的微生物群落,这对人体的菌群平衡具有重要意义。
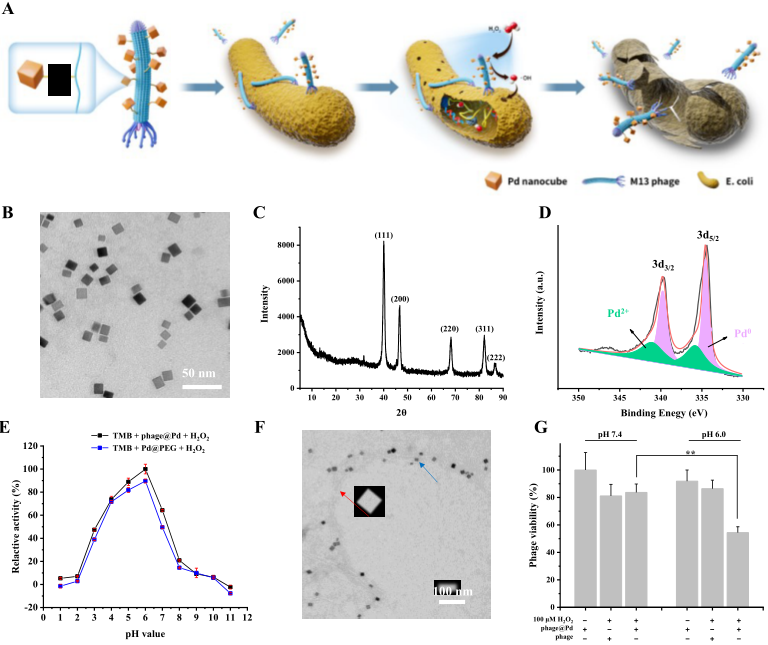
图1 Pd纳米酶、Pd@PEG和噬菌体@Pd的设计与表征(摘自Advanced Materials )
然而,感染部位的细菌种群通常是一个复杂的系统,不仅有多种细菌,而且有独特的代谢微环境,具有低pH、高活性氧(ROS)、特定酶、营养缺乏等特点。因此,传统的噬菌体疗法可能受到抗菌谱狭窄、微环境苛刻等限制,导致细菌根除效率低。为克服这些限制,Peng等[1]制备了嵌合M13噬菌体以扩大抗菌谱,并结合金纳米棒通过光热消融来消融各类细菌。Wang等[2]报道了一种用于对抗铜绿假单胞菌(P. aeruginosa)感染的光催化量子点武装噬菌体(QD)。QD噬保留了噬菌体的特异性结合能力,以帮助QD定位在细菌表面。在外部光照射下,产生单线态氧(1O2)对浮游细菌和生物膜进行强力消除。然而,这些治疗强烈依赖于外部光照射,因而受到组织穿透的限制,并且需要对感染部位进行精确定位,从而降低了其临床效果。
与外源刺激的纳米系统相比,疾病微环境中的内源性刺激(如pH、酶、氧化还原或葡萄糖)具有区域特异性,能够根据疾病的进程进行动态调整,这是设计智能响应纳米系统的优选响应物。纳米酶是具有类酶性质的纳米材料,在过去十年中发展迅速,其能够解决天然酶在低稳定性、高成本和难以储存等方面限制。纳米酶具有微环境响应性的催化活性,因其广谱抗菌性能和可忽略的毒性而被广泛研究。具有类过氧化物酶(POD)活性的纳米酶可以将过量表达的过氧化氢(H2O2)转化为更具毒性的羟基自由基(·OH),从而有效根除感染区域的细菌甚至生物膜。虽然活性氧是非常活跃的分子,可以在几秒钟内杀死细菌,但活性氧10-6-10-9秒的超短寿命阻止其有效地扩散到目标,利用率低。此外,选择性和特异性差是纳米酶面临的共同挑战。因此,迫切需要寻找一种新的方法来提高纳米酶的选择性/特异性和局部递送,以在保证生物安全的基础上改善治疗效果。
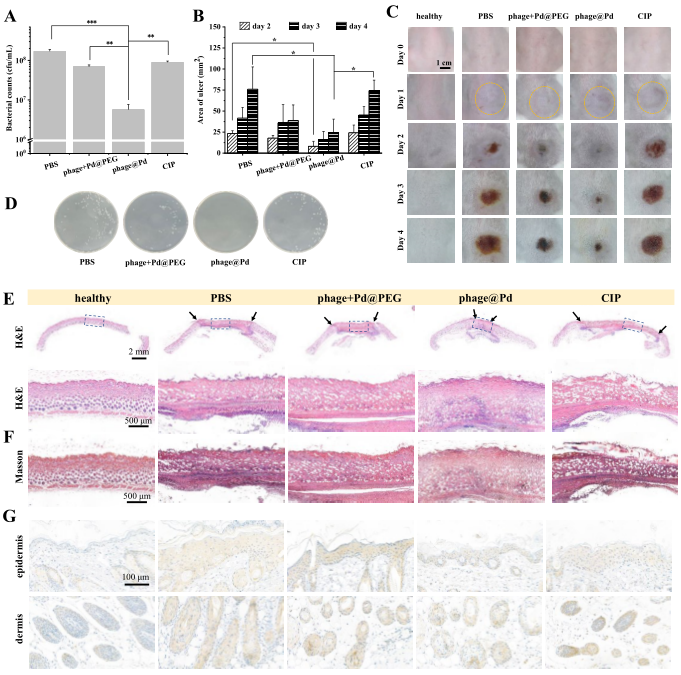
图2 噬菌体@Pd的体内治疗效果(摘自Advanced Materials )
为满足上述需求,该研究构建了一种创新型纳米酶修饰噬菌体(phage@Pd)系统,以精确识别、粘附和杀死感染部位的细菌。该平台中,温和且相对安全的M13噬菌体能够选择性粘附细菌,与裂解性噬菌体相比,不会释放大量免疫原性病原体相关的分子模式(PAMPs)。此外,超小钯(Pd)纳米酶因其突出的pH依赖性POD-活性、良好的生物安全性和小尺寸而被选为广谱抗菌剂。Phage@Pd通过NHS-聚乙二醇化Pd纳米酶上的-NHS基团与噬菌体上的氨基(-NH2)之间的酰胺化反应制备。在phage@Pd的设计中,噬菌体成分能够选择性地粘附或非特异性地包裹细菌,而Pd成分受到感染的酸性微环境的刺激并在近距离产生毒性OH,从而大大提高了phage@Pd对浮游细菌和生物膜细菌的抗菌效率。最后,急性细菌性肺炎模型以及皮下生物膜模型证明,phage@Pd在体内表现出显著的治疗潜力,能够杀死感染细菌、促进组织修复,且不引起严重炎症。
参考文献:
[1] H. Peng, R. E. Borg, L. P. Dow, B. L. Pruitt, I. A. Chen, Proceedings of the National Academy of Sciences of the United States of America 2020, 117, 1951-1961.
[2] L. Wang, X. Fan, M. G. Moreno, T. Tkhilaishvili, W. J. Du, X. L. Zhang, C. X. Nie, A. Trampuz, R. Haag, Advanced Science 2022, 9, 2105668.
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202301349


