BMJ | 替雷利珠单抗联合化疗显著改善晚期胃癌或胃食管交界处腺癌患者的总生存期
时间:2024-06-17 13:00:40 热度:37.1℃ 作者:网络
胃癌是全球最常见的癌症类型之一,2020年全球新诊断病例超过100万,死亡人数超过76.8万,胃癌在亚洲更为常见,约占全球新诊断病例的75%,而欧洲和北美的比例仅为16%,中国、韩国和日本是胃癌高发地区,在免疫治疗出现之前,晚期胃癌或胃食管交界处腺癌的标准一线治疗方案是含铂类化疗药物,中位总生存期很少超过12个月,程序性死亡配体1(PD-L1)表达水平被认为是评估抗PD-1抗体疗效的潜在生物标志物,目前免疫检查点抑制剂,如抗PD-1/PD-L1抗体,已在多种实体瘤的治疗中取得了突破性进展,尽管一些国家已批准将抗PD-1抗体(如纳武利尤单抗、帕博利珠单抗和信迪利单抗)与化疗联合用于治疗晚期胃癌或胃食管交界处腺癌,但相关研究的结果并不一致,引发了关于抗PD-1抗体在胃癌或胃食管交界处腺癌中的生存获益及其与PD-L1表达水平关系的争论,该研究旨在评估将抗PD-1抗体替雷利珠单抗与化疗联合作为晚期胃癌或胃食管交界处腺癌一线治疗的疗效和安全性。

方法
该研究是一项随机、双盲、安慰剂对照、3期临床试验,纳入了年龄≥18岁,经组织学证实为局部晚期不可切除或转移性胃癌或胃食管交界处腺癌的患者,既往未接受过晚期疾病的全身抗癌治疗,ECOG体力状态评分为0或1,至少有一个可测量或不可测量的病变,患者被随机分配(1:1)接受替雷利珠单抗200 mg或安慰剂静脉注射,每3周1次,联合化疗(研究者选择的奥沙利铂+卡培他滨或顺铂+5-氟尿嘧啶),并进行分层,治疗持续至疾病进展或出现不可接受的毒性,主要终点为总体生存期(OS),在PD-L1 TAP评分≥5%的患者和所有随机分组患者中评估。
研究结果
PD-L1 TAP评分≥5%的患者:在中期分析时,替雷利珠单抗联合化疗与安慰剂联合化疗相比,OS显示出显著改善(中位OS:17.2个月 vs 12.6个月;风险比0.74;P=0.006),在最终分析时,替雷利珠单抗联合化疗与安慰剂联合化疗相比,OS和PFS均得到改善,客观缓解率和缓解持续时间也得到改善。
所有随机分组患者:在最终分析时,替雷利珠单抗联合化疗与安慰剂联合化疗相比,OS显示出显著改善(中位OS:15.0个月 vs 12.9个月;风险比0.80;P=0.001),在替雷利珠单抗联合化疗组中,18个月和24个月的OS率分别为42%和33%,而安慰剂联合化疗组分别为33%和23%。

安全性分析
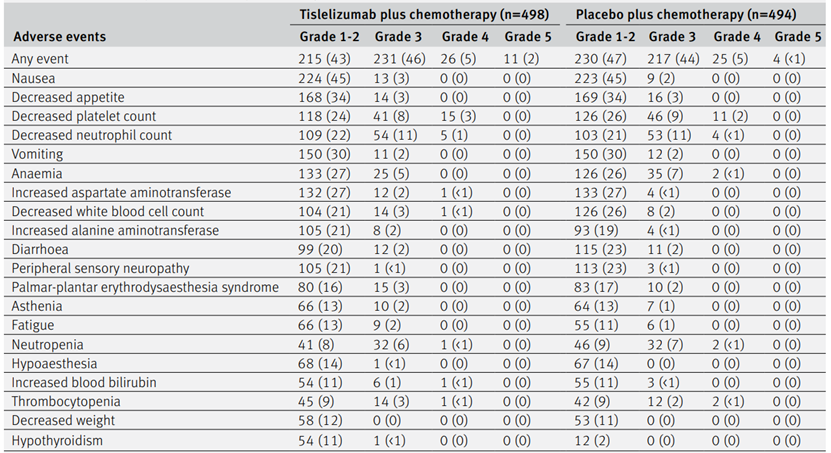
替雷利珠单抗联合化疗组中,97%的患者报告了TEAEs,而安慰剂联合化疗组为96%,替雷利珠单抗联合化疗组中,54%的患者报告了3级或更高级别的TEAEs,而安慰剂联合化疗组为50%,最常见的3级或4级TEAEs包括中性粒细胞计数减少、血小板计数减少、中性粒细胞减少和贫血,替雷利珠单抗联合化疗组中,23%的患者报告了sTEAEs,而安慰剂联合化疗组为15%,替雷利珠单抗联合化疗组中,31%的患者报告了irAEs,而安慰剂联合化疗组为12%,替雷利珠单抗联合化疗组中,8%的患者报告了3级或更高级别的irAEs,而安慰剂联合化疗组为2%,最常见的irAEs包括甲状腺功能减退症、皮疹、肺炎和肝炎,替雷利珠单抗联合化疗组中,1%的患者因治疗相关事件死亡,而安慰剂联合化疗组为0.4%,替雷利珠单抗联合化疗的安全性可控,与替雷利珠单抗和化疗的已知安全性特征一致,免疫相关不良事件的发生率较低,大多数为1级或2级,化疗的毒性没有因替雷利珠单抗的加入而恶化。
结论
替雷利珠单抗联合化疗作为晚期或转移性胃癌或胃食管交界处腺癌的一线治疗,与安慰剂联合化疗相比,为PD-L1 TAP评分≥5%的患者和所有随机分组患者提供了显著的OS获益,且安全性可控。
原始出处
Qiu M-Z, et al. 2024. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first line treatment for advanced gastric or gastro-oesophageal junction adenocarcinoma: RATIONALE-305 randomised, double blind, phase 3 trial. Bmj.


