读书报告 | 首创EGFR-HER3双特异性抗体偶联药物BL-B01D1治疗晚期实体瘤的I期临床研究
时间:2024-10-31 12:00:38 热度:37.1℃ 作者:网络
导读
EGFR和HER3属于ERBB家族的受体酪氨酸激酶。EGFR和HER3基因扩增或突变与下游信号通路的异常激活相关,从而促进肿瘤发生、肿瘤生长和肿瘤进展。EGFR和HER3在多种实体瘤如肺癌、头颈癌、食管癌和结直肠癌中均有较高表达。EGFR-HER3是一款EGFR-HER3双特异性抗体偶联药物(ADC),由双特异性抗体、基于四肽的可切割连接体和毒素Ed-04(拓扑异构酶I抑制剂)组成。
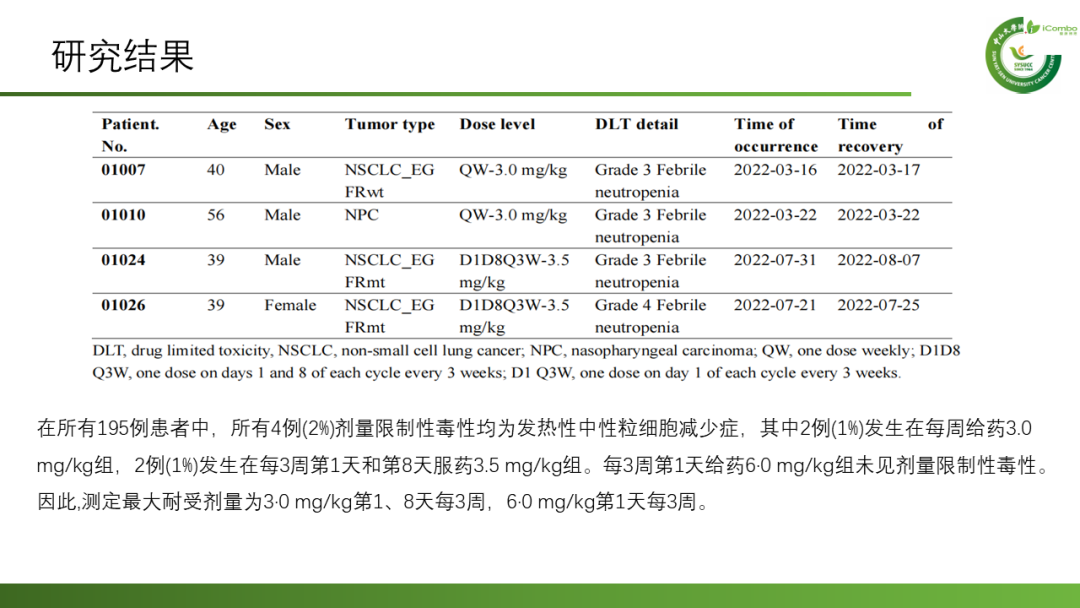
中山大学肿瘤防治中心赵洪云、张力课题组开展了评估BL-B01D1在局部晚期或转移性实体瘤接受标准治疗失败的患者中的安全性、抗肿瘤活性的多中心I期临床研究。该I期临床试验分为1a期(剂量递增期)、1b期(剂量扩大期)。1a期采用i3+3联合加速滴定设计,患者分组接受三种 BL-B01D1 静脉注射方案:每周方案,爬坡剂量为 0.27 mg/kg、1.5 mg/kg和3.0 mg/kg;3周方案且在第1天和第8天注射,爬坡剂量为2.5 mg/kg、3.0 mg/kg和3.5 mg/kg;3 周方案第1天注射,爬坡剂量为5.0 mg/kg 和6.0 mg/kg。根据1a期的试验结果,确定1b期患者接受以下两种BL-B01D1 静脉注射方案:3周方案且在第1天和第8天注射,剂量级为2.5和3.0mg/kg;3周方案第1天注射,剂量级为4.5mg/kg、5.0 mg/kg、6.0mg/kg。
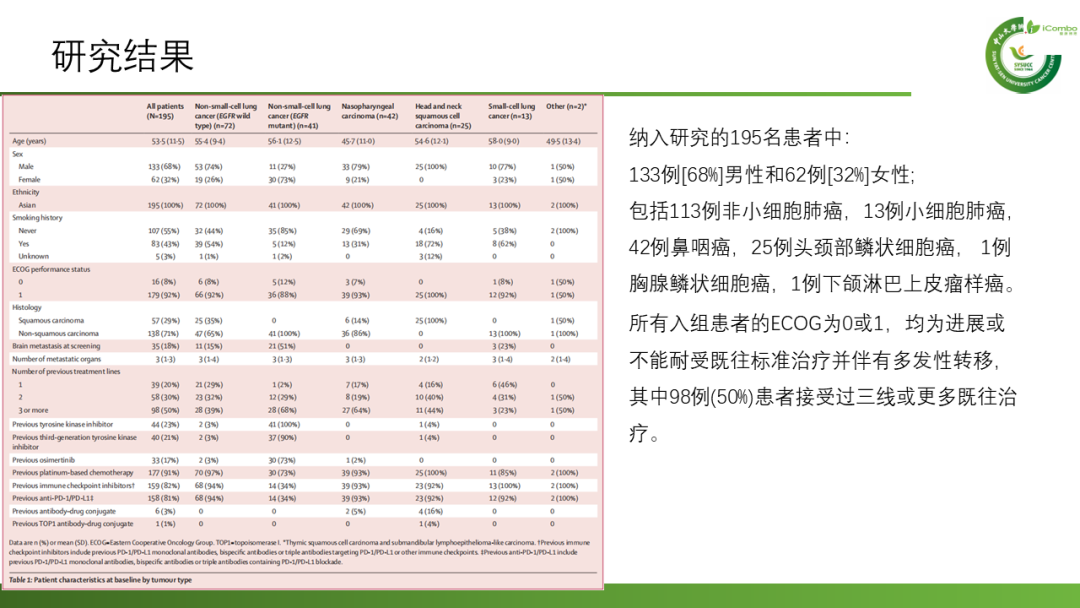
从2021年12月8日至2023年3月13日期间,共纳入195例患者,其中1a期纳入25例,1b期纳入170例。纳入研究的195名患者中,包括113例非小细胞肺癌、13例小细胞肺癌、42例鼻咽癌、25例头颈部鳞状细胞癌、1例胸腺鳞状细胞癌和1例下颌淋巴上皮瘤样癌。患者均为进展或不能耐受既往标准治疗并伴有多发性转移,其中98例(50%)患者接受过三线或更多既往治疗。
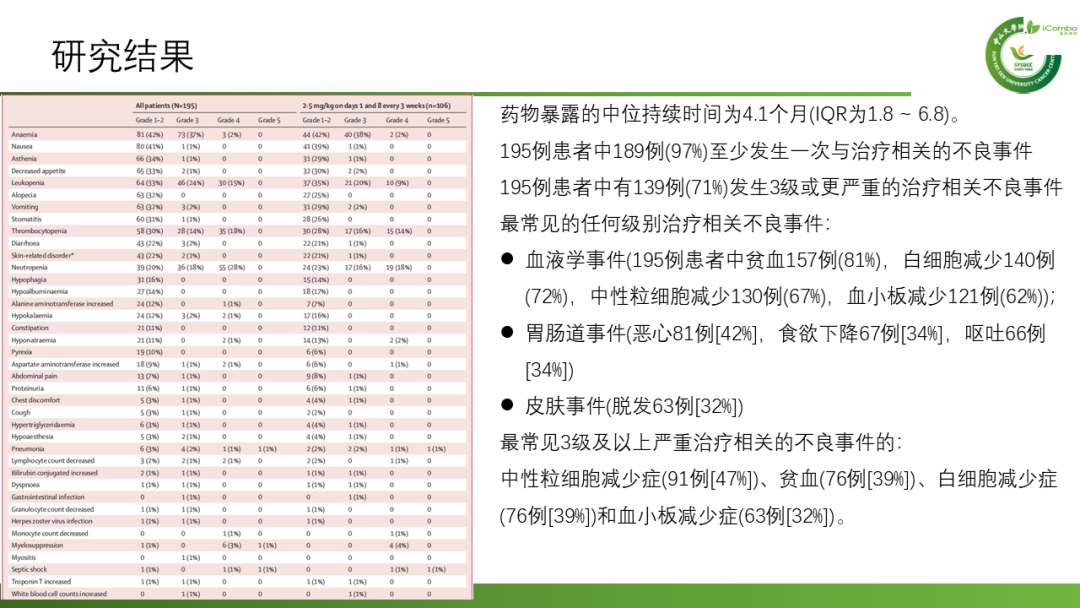
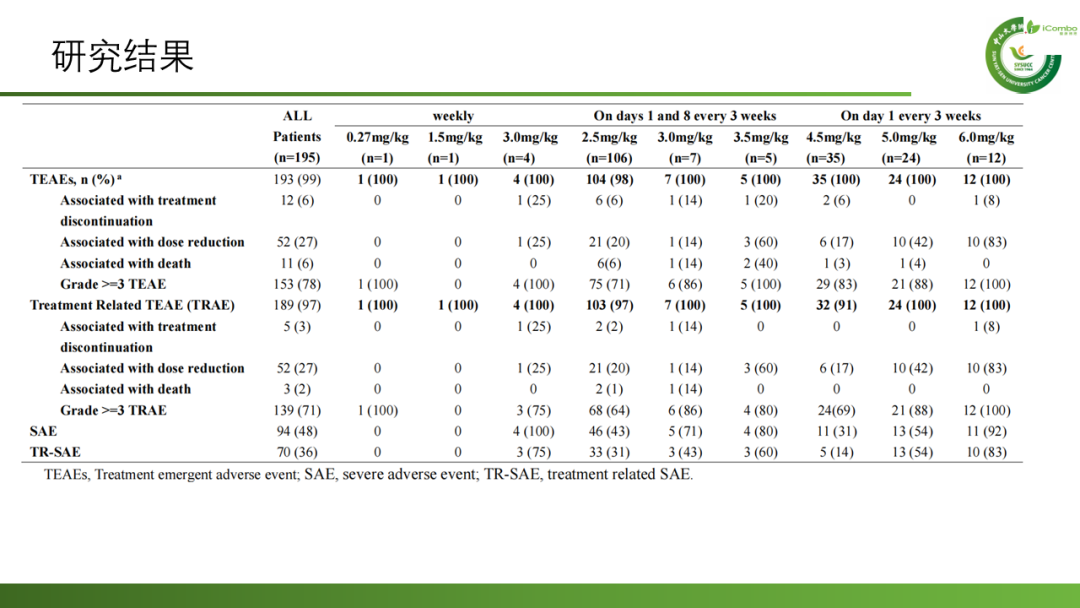
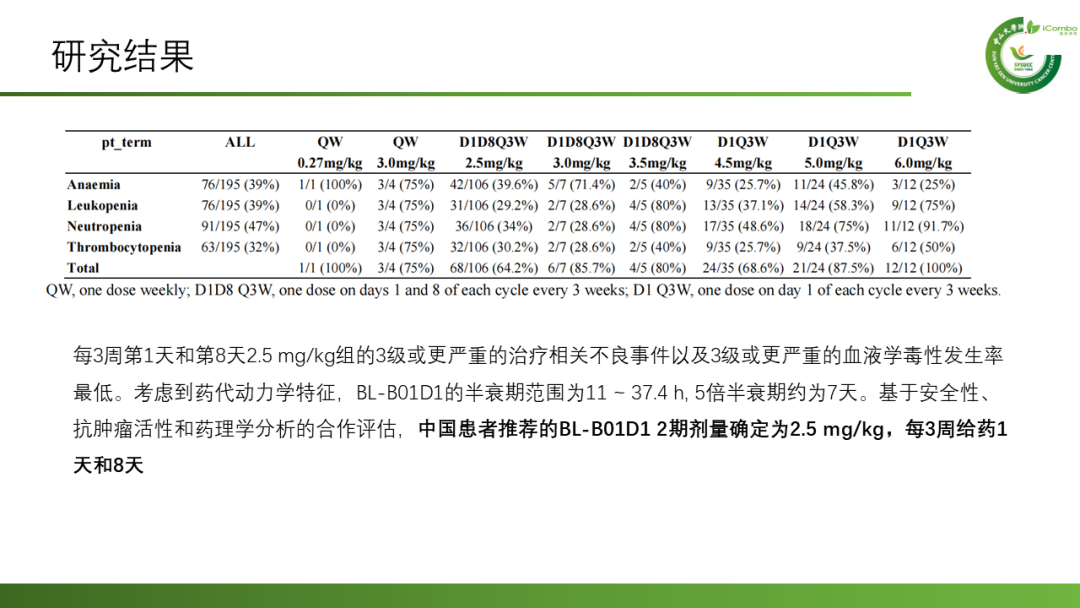
安全性:195例患者中189例(97%)至少发生一次与治疗相关的不良事件,139例(71%)发生3级或更严重的治疗相关不良事件。最常见的任何级别治疗相关不良事件:血液学事件、胃肠道事件、皮肤事件。最常见3级及以上严重治疗相关的不良事件的:中性粒细胞减少症、贫血、白细胞减少症和血小板减少症。
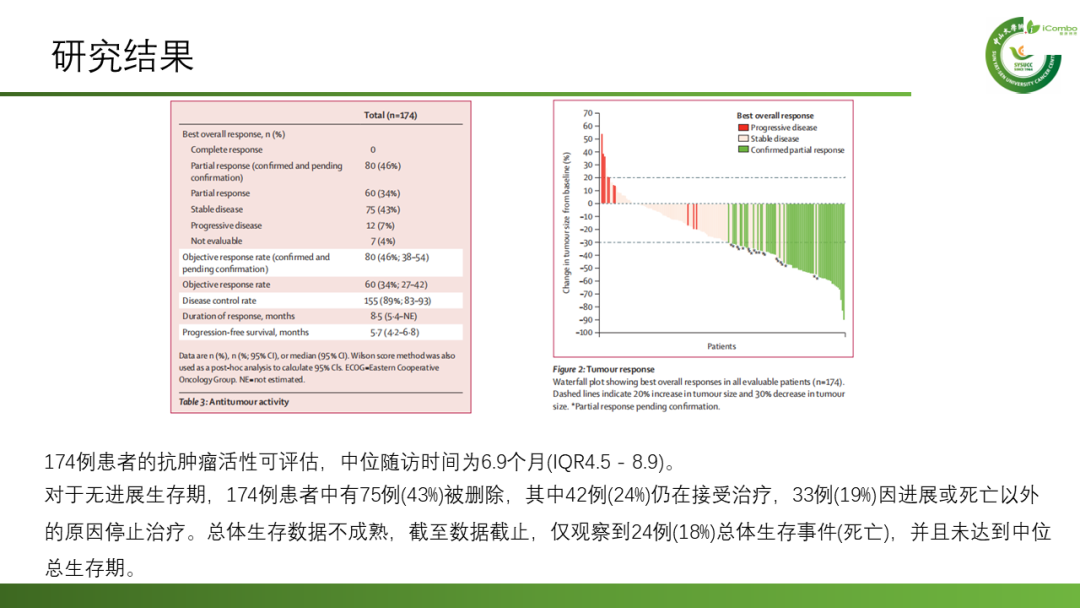
有效性:174例患者纳入分析,中位随访时间为6.9个月(IQR4.5 - 8.9),ORR 46%, DCR 89%,mPFS 5.7个月, DOR 8.5个月。 OS数据尚不成熟。
总而言之,该试验是首个针对EGFR和HER3的双特异性抗体偶联药物的人体研究,结果表明BL-B01D1是安全的,对局部晚期或转移性实体瘤患者具有初步的抗肿瘤活性。该I期试验的主要目标已经实现,推荐的2期剂量设定为每3周第1天和第8天2.5 mg/kg。目前也正在进行NSCLC和鼻咽癌患者的2期和3期临床试验(Lancet Oncol. 2024 Jul;25(7):901-911. doi: 10.1016/S1470-2045 (24)00159-1)。