【Blood】如何用二代测序MRD改善ALL移植前风险分层和预防移植后复发
时间:2024-06-04 21:01:57 热度:37.1℃ 作者:网络
二代测序MRD
利用B细胞受体(BCR)和T细胞受体(TCR)基因重排的二代测序(NGS)来量化可测量残留病(MRD),是儿童和成人急性淋巴细胞白血病(ALL)临床管理的重大进展,例如ClonoSEQ(Adaptive公司,FDA已批准)就是B-ALL中一种基于NGS的MRD体外诊断检测手段。相对于多参数流式细胞术(MFC)或定量PCR, NGS-MRD在细胞充足的骨髓标本中可实现更大的白血病检测深度,至少为10-6或0.0001%。增加的MRD敏感性可改善预后,并为预防临床复发的干预提供更大的提前量。此外,NGS-MRD可实现克隆跟踪,且血液和骨髓MRD结果之间具有强相关性,从而为通过较低侵入性的手段监测MRD提供了机会。
异基因造血细胞移植(HCT)目前用于非移植治疗中疾病复发高风险的儿童和成人ALL患者,即初始诱导/巩固后持续MRD阳性患者或首次或之后复发的患者。目前支持在HCT中使用NGS-MRD的文献越来越多,但移植背景下NGS-MRD检测的最佳时机、解释的细微差别以及基于围HCT期MRD结果的治疗干预选择,导致该技术的使用较为复杂化。
Blood近日发表的一篇文章中,作者通过一个典型的B-ALL患者病例,说明了在异基因HCT中使用clonoSEQ NGS-MRD检测的临床要点和专家指导。
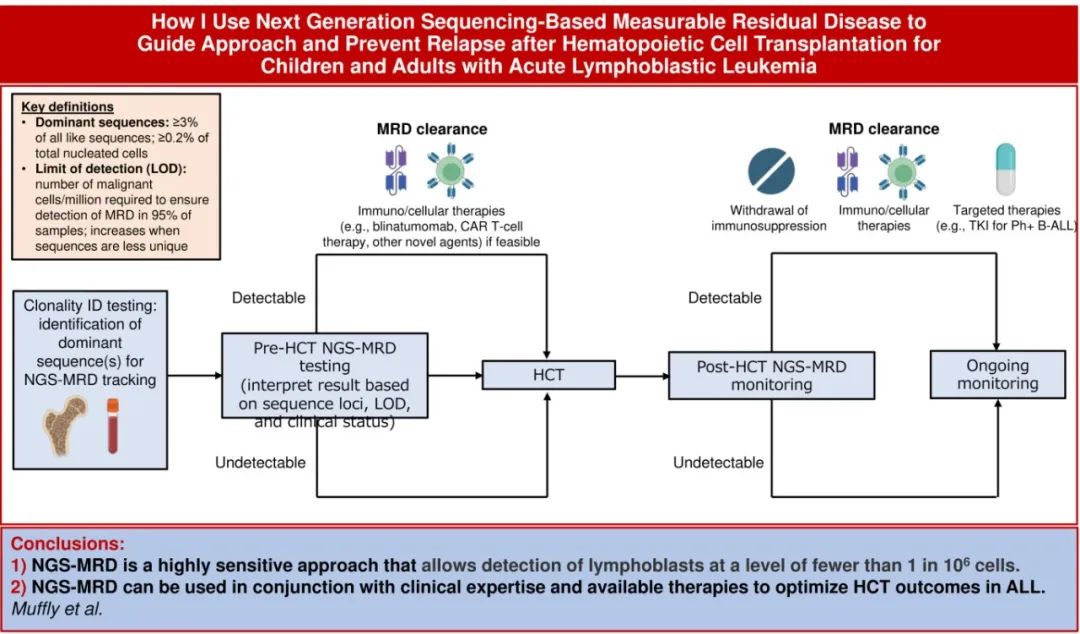
临床案例
一名20岁女性诊断为Ph样P2RY8-CRLF2重排B-ALL。诊断时的骨髓穿刺样本进行clonoSEQ鉴定,证实存在2个优势克隆序列(dominant sequence):序列A,10万个有核细胞中存在65万个的IgH(重链)克隆序列;序列B,10万个有核细胞中存在58万个的Igκ (κ) 克隆序列。儿童多药化疗诱导后实现形态学完全缓解(CR),流式细胞术显示残留白血病原始细胞为0.8%,巩固治疗后白血病原始细胞增加到6%。然后患者接受CD19 CAR-T细胞治疗,并通过形态学和流式细胞术实现CR,但在CAR-T细胞输注3个月后clonoSEQ检测残留疾病恢复阳性,每百万有核细胞中检测到序列A (IgH)的克隆细胞有2个,每百万有核细胞中检测到序列B (Igκ)的克隆细胞有5个。实验室检测结果显示,患者CD19计数为80个细胞/L。建议采用异基因HCT巩固。
确定用于NGS-MRD跟踪的优势序列
该病例展示了在ALL中使用NGS-MRD的几个要点。首先,与流式细胞术不同(诊断样本通常不需要用于后续MRD评估),使用clonoSEQ需要对诊断性白血病物质进行初始测序,以确定MRD跟踪的优势克隆序列。因此,在初始白血病检查中需要送检新鲜骨髓穿刺样本或外周血进行克隆性评估(图1)。未染色的骨髓穿刺样本载玻片、touch prep载玻片或外周血涂片也可用于确定序列,但脱钙骨髓穿刺活检(decalcified bone marrow core biopsy)不适用。对于以淋巴瘤为主要表现的ALL患者,未固定的冷冻组织或福尔马林固定的石蜡包埋切片或scrolls可能合适。具有高肿瘤负荷且能清楚地代表细胞形态学定义的疾病的样品是首选。部分项目会对所有新诊断ALL患者进行clonoSEQ克隆鉴定检查,如果不可行,建议对可能接受HCT的患者进行克隆鉴定检查。如果在诊断时没有送检clonoSEQ鉴定检查,那么在HCT评估时,建议送检诊断时获得或储存的样本或载玻片。许多中心都在诊断时留存样本用于后续检测,Adaptive公司可利用初始样本或载玻片来确定跟踪序列。

鉴定优势序列是通过分析诊断样本中存在的独特V(D)J和/或TCR基因重排来进行的。优势序列必须代表来自相同基因座的≥3%的序列(即IgH、Igκ或Igλ)和含高比例原始细胞样品中≥0.2%的总有核细胞。既往研究表明,检测的ALL样本中约90%含优势序列。未能确定优势序列的最常见原因为原始细胞未成熟而导致尚未发生重排(例如,在大约1/3的早期T细胞前体ALL中)、DNA质量差或评估样本中肿瘤负荷低。对于BCR中没有优势序列的B-ALL患者,约半数有TCRβ或TCRγ重排,可用于MRD跟踪;但关于TCR监测在这种情况下是否具有相同水平临床效用尚缺乏数据。
一旦确定优势序列,然后根据对数百个个体数据库的调查和位点特异性 V(D)J 重排的计算建模,为每个优势序列分配一个“唯一性”度量。这种唯一性指标随后用于确定灵敏度和检测限(LOD,定义为确保95%的样本中检测到MRD所需的每百万恶性细胞的数量,较低的数字表示较高的灵敏度,见图1)。鉴定优势序列之后就可以对未来的骨髓穿刺物或血液样本进行MRD评估。值得注意的是,如果初始样本的informative序列鉴定不成功,或者初始样本的DNA质量较差或肿瘤负荷较低,如果出现了informative优势序列,则随后复发中可再次送检样本。
HCT前NGS-MRD的考虑因素
CAR-T细胞治疗后,NGS-MRD检测到残留疾病与临床复发风险显著增加有关。在tisagenlecleucel CAR-T细胞输注后超过一个月检测到NGS-MRD的情况下,未曾移植的患者应考虑异基因HCT,因为这些患者无论是否存在持续性B细胞发育不全(aplasia),都极有可能复发。HCT作为CAR-T细胞治疗后NGS-MRD阴性缓解儿童的巩固作用最近得到了广泛的回顾,有数据表明,部分持续NGS-MRD阴性的患者可以避免HCT。接受CAR-T细胞治疗的患者出现NGS-MRD阳性时,不知道原始细胞是否仍表达CD19或CD22,会导致治疗选择变得困难。使用HCT巩固成人ALL患者CAR-T细胞治疗的反应仍是一个有争议的领域,但作者目前的做法为,对于接受商业CAR-T细胞治疗后达到NGS-MRD阴性CR但无法长期持续的未曾移植的成年ALL患者,考虑进行巩固性HCT。CAR-CURE 研究(NCT05621291)纳入CAR-T细胞治疗后可以长期持续(tisagenlecleucel)的儿童和年轻人患者(1-25岁),连续随访NGS-MRD,以确定哪些患者可以避免HCT。也提倡在成人ALL中开展类似研究。
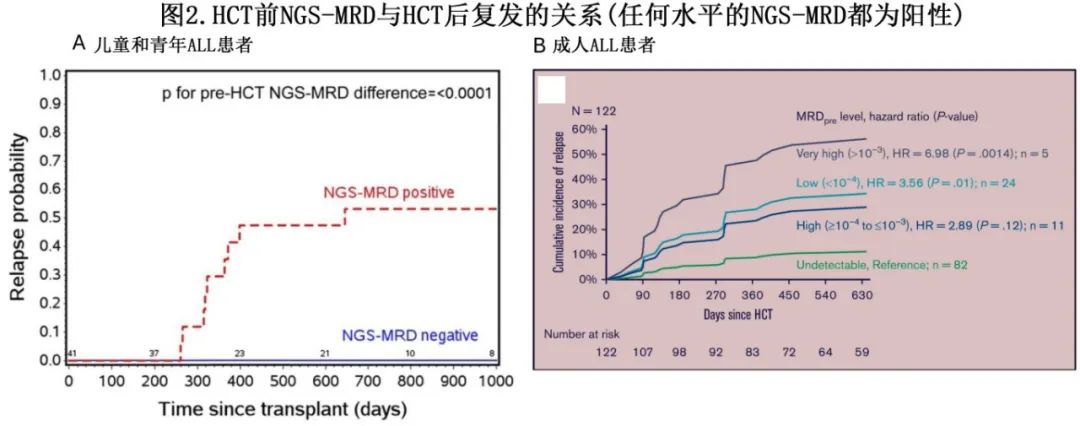
一般来说,在HCT之前应尽量清除NGS-MRD。多项研究表明,在HCT之前,通过NGS检测到任何水平MRD都可以预测HCT后复发风险增加和生存期较差。这在儿童肿瘤组/儿童移植和细胞治疗联盟ASCT0431研究中对儿童和青少年的分析中得到证明,其中HCT前NGS-MRD阳性患者的两年复发率为53%,而NGS-MRD阴性患者为0%(图2A)。即使在MRD检测水平最低(<10-6)的患者中,复发风险也很高。与HCT前的MFC相比,HCT前的NGS-MRD提高了对HCT后复发和总生存期(OS)的鉴别。在成人ALL患者中也有类似发现,任何水平的HCT前NGS-MRD阳性结果均与不良移植结局相关(图2B)。
贝林妥欧单抗已被FDA批准用于MRD≥10-3的首次或二次CR的儿童和成人B-ALL,虽然期研究中没有评在NGS-MRD水平低于10-3时的疗效,但研究表明它是可行的,并且在两项小型研究中,在MRD极低患者中,有13/19和14/26的NGS-MRD阳性患者在使用贝林妥欧单抗后清除NGS-MRD。此外,尽管CAR-T细胞最初仅在复发或难治的形态学B-ALL患者中进行评估,但真实世界研究表明,CAR-T细胞疗法通常可成功地用于完全缓解的患者(包括tisagenleucel治疗儿童和brexucabtagene治疗成人),以清除可检测的MRD,但还外更多前瞻性研究证实。
HCT前深度清除MRD的目标必须与其他实际因素(如移植和供者协调)进行权衡。旨在减少NGS-MRD的治疗可能并不可行,因为移植时间可能因供者选择和可用性而异。此外,在移植前给予旨在将NGS-MRD降至零的额外治疗可能并不有效,并且可能导致增加毒性和移植延迟。如果无法清除NGS-MRD且患者适合HCT,建议继续进行HCT,因为研究表明,对于HCT前NGS-MRD为阳性(MFC为阴性)的儿童和年轻人,至少半数仍可经历长期无病生存。
案例(续)
患者接受全身照射(TBI)和氟达拉滨的清髓性预处理,然后使用HLA相合非亲缘供者进行HCT。移植物病毒宿主病(GVHD)预防包括后置环磷酰胺(PTCy)、他克莫司和霉酚酸酯。HCT后28天复查骨髓,显示CR伴MFC和clonoSEQ NGS-MRD残留病变阴性。
基于NGS-MRD调整HCT设计和HCT后方案
移植预处理、GVHD预防和HCT后维持治疗方案,可能在一定程度上受到围HCT期NGS-MRD结果的指导(图3)。清髓性TBI是ALL预处理的标准组成部分,可导致儿童晚期效应增加,成人HCT后出现第二原发恶性肿瘤。回顾性数据显示,HCT前的NGS-MRD可以区分需要清髓性TBI的患者和可以安全忽略TBI的患者。在一项研究中,与非TBI清髓性化疗方案相比,接受基于TBI的清髓性治疗方案后,NGS-MRD阳性的儿童和年轻人的复发率显著降低,无事件生存期(EFS)得到改善。然而,HCT前NGS-MRD阴性患者在TBI或非TBI治疗后的预后同样优异。PTCTC ONC1701 EndRAD研究(NCTN03509961)是一项针对25岁以下儿童和年轻人的2期前瞻性研究,旨在使用NGS-MRD升级或降级移植预处理。作为该研究一部分,一个大型观察性队列的早期结果表明,对于HCT前NGS-MRD阴性患者,清髓性TBI或可忽略;但更大的EndRAD II期队列的报告尚未公布,而且迄今为止尚未进行结论性随机研究。成人ALL中缺乏该问题的数据,但急性髓性白血病和骨髓增生异常综合征的研究结果表明,HCT前的NGS-MRD或可鉴别需要清髓性移植预处理方案和减低强度预处理已足够的成年患者。
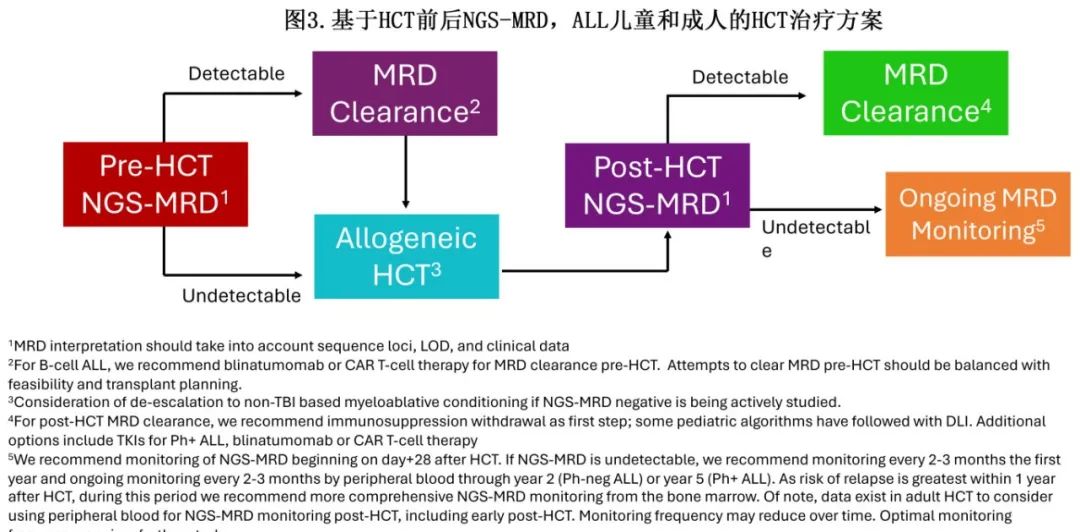
HCT后持续或新出现NGS-MRD阳性提示即将临床复发,预示预后不良。预防新出现NGS-MRD或治疗低水平MRD的干预措施包括,减少HCT后免疫抑制以诱导移植物抗白血病(GVL)和/或引入其他药物以巩固或维持缓解。在HCT后首次检测到NGS-MRD和临床复发之间存在大约3-6个月的干预“窗口期”。由于急性GVHD的发生与B或T-ALL复发呈反比关系,HCT后早期减少或撤销免疫抑制是一种有价值的策略。事实上,对儿童ASCT0431研究的二次分析表明,在HCT后MRD阳性患者中,与未发生GVHD的患者相比,发生急性GVHD的患者复发风险较低、EFS较高。然而,只有I-III级急性GVHD的儿童患者获得临床获益,因为IV级急性GVHD患者中复发风险的降低被移植相关死亡率的增加所抵消。一项北美、欧洲和澳大利亚的大型回顾性多中心儿童研究也发现该关联;HCT后MRD阳性的急性GVHD患者的复发率与MRD阴性但未发生急性GVHD的患者相似。有报道称,撤销免疫抑制导致HCT后NGS-MRD清除;但该方案必须在权衡相关风险和获益后,在个体化的基础上应用,因为报道这种方法的文献有限,而且大多是回顾性(见表1)。

对于费城染色体阳性(Ph+) B-ALL患者,可以使用酪氨酸激酶抑制剂来降低MRD或作为HCT后维持治疗。尽管消除HCT后NGS-MRD的理想干预措施尚不明确,但在MRD+患者中使用贝林妥欧单抗和CAR-T细胞治疗的出色数据表明,对于HCT后新出现的或持续的NGS-MRD患者,这两种方法都是合理的。供者来源的异基因CAR-T细胞清除HCT后MRD也在研究中。
案例(续)
在HCT后60天,患者发生II期急性皮肤GVHD,局部类固醇治疗后缓解。HCT后90天重复骨髓穿刺显示持续完全缓解;clonoSEQ NGS-MRD检测不到序列A (IgH) (LOD <1/100万个有核细胞),但检测到序列B (Igκ) <1/100万个有核细胞(LOD 47/100万个有核细胞)。1个月后复查clonseq NGS-MRD为阴性。患者在HCT后5个月逐渐停用他克莫司,未发生GVHD。HCT后6、9和12个月送检骨髓ClonoSEQ,残留疾病呈阴性。在HCT后的第二年,每2-3个月监测一次外周血clonoSEQ,结果仍为阴性。
对NGS-MRD结果的解读和HCT后监测
正确解读clonoSEQ报告结果对于临床决策中使用该检测至关重要(表2)。尽管部分B-ALL患者可能有一个优势序列,但其他患者可能在不同的位点上有多个优势序列。使用该方法监测B-ALL MRD时,应注意报告中描述的优势序列的LOD,因为较高LOD的序列产生非特异性信号的风险有所增加。相对于IgH(重链)序列,由于IgH位点相对于轻链位点具有更大的多样性和独特性,因此Igκ和Ig(轻链)序列往往具有更高的LOD。这是生物学的结果,重链重排V、D和J,而轻链只重排V和J,因此多样性的机会较少。大约60%已鉴定的克隆序列由于其高度独特性而具有非常低的LOD,而20%的序列具有中等独特性,20%的序列不那么独特(更有可能作为背景克隆存在)。影响LOD的另一个因素为样品中有核细胞的数量。当被测样品中存在至少190万个有核细胞时,检测MRD的最佳LOD灵敏度为每百万细胞中有1个。尽管在评估有核细胞数量较少的样品时仍然可以检测到MRD,但每百万的LOD会增加,并且在所检测到的MRD周围的95%置信区间(每百万的整数值)会更宽。如果追踪患者的TCRβ或TCRγ序列,唯一性可能较低(见下一节:没有IgH序列的T-ALL和B-ALL)。重要的是要记住,虽然孤立性不太独特的序列可能代表着含有克隆扩增的非疾病,但当不太独特的序列与更特异性的(低LOD)序列相匹配时,这种不太独特的序列可能代表真正的疾病,不应忽视。
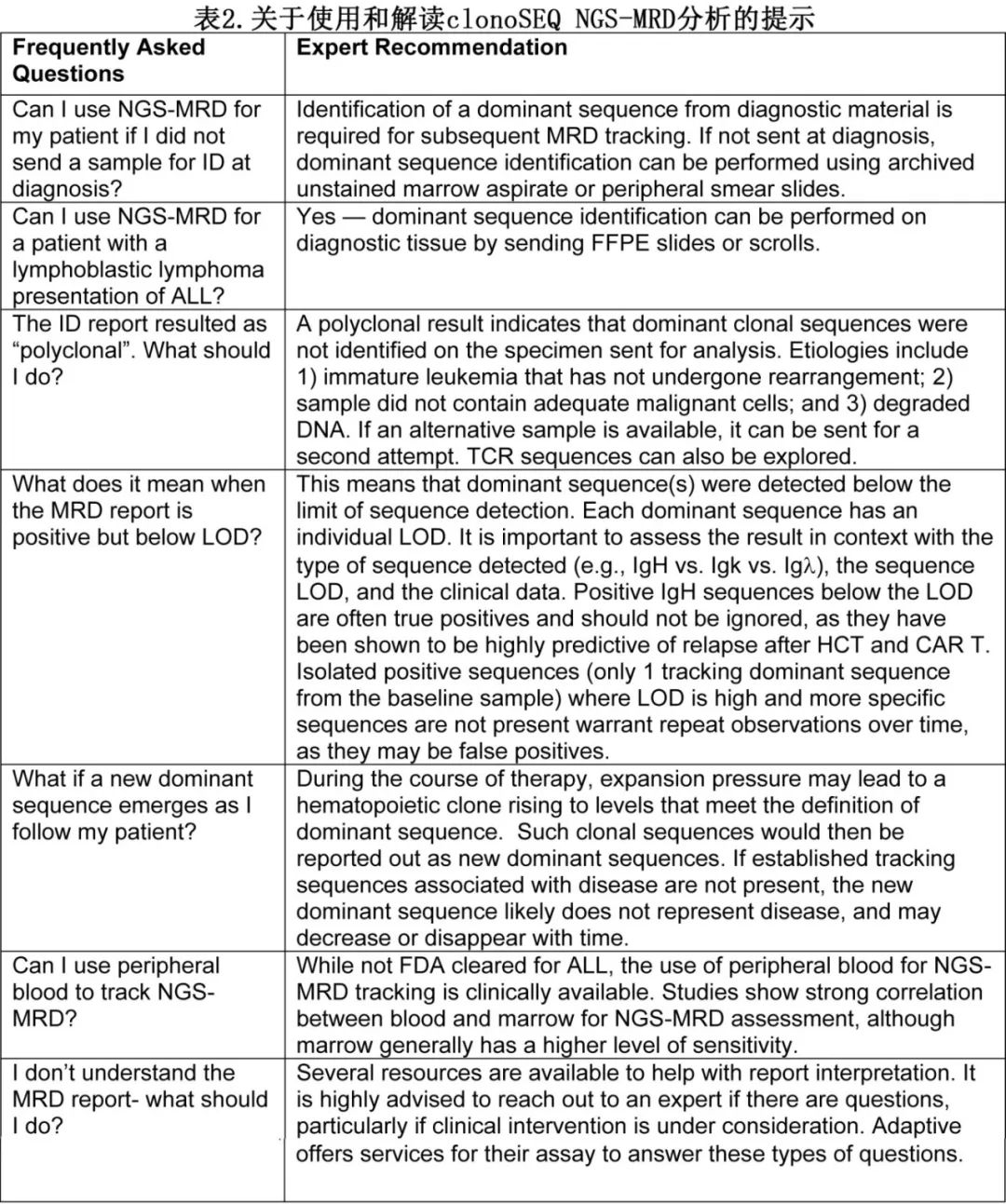
具体到病例,未检测到序列A,它是一个具有LOD <1/100万个有核细胞的IgH优势克隆序列,但在<1/100万有核细胞的克隆细胞中检测到序列B(一个LOD为47/100万有核细胞的Igκ序列)。在这种情况下,虽然最初可能会担心MRD是“可检测的”,但缺乏更独特的IgH克隆序列的检测令人放心。在这方面,在一项对接受HCT的成年患者的分析中,研究表明,在没有可检测IgH序列的情况下,MRD检测到不太敏感的Igκ和Igλ克隆序列与临床复发无关。偶尔也会出现新的优势克隆序列(符合上述优势序列标准的序列,如图1所示),最常见于HCT后。这些序列也应该在患者临床病程的背景下进行解释,因为它们在目前的研究中未与复发密切相关,它们可能是与疾病无关的克隆扩增,并且大多数随着时间的推移倾向于退隐到背景中(图2)。因此,在临床实践中使用clonoSEQ测定时,重要的是要纳入所有临床数据:优势序列位点和序列LOD、序列随时间的跟踪行为、以及样品中的序列丰度,以便更好地告知MRD结果。对于复杂病例,Adaptive公司以及该领域的专家都可以提供咨询。
在HCT之后,监测NGS-MRD可为持续MRD阴性患者提供了保证,而为出现MRD阳性的患者发出早期警报,考虑进行干预。HCT后MRD阴性患者的理想监测频率和持续时间仍有争议;作者建议对Ph阴性B-ALL患者进行约2年的HCT后评估,对Ph+ B-ALL患者进行长达5年的HCT后评估(图3)。在停用TKI后,Ph+ B-ALL患者晚期复发更为常见,因此需要更长的MRD随访。令人欣慰的是,进入HCT时未检测到NGS-MRD的患者在HCT后的第一年仍为NGS-MRD阴性,结局非常好,随后的复发率非常低。
最近的文献支持使用外周血作为骨髓穿刺的替代进行NGS -MRD监测(表1)。在一项接受HCT或CAR-T细胞治疗的成人ALL患者的前瞻性观察研究中(n=62),配对的血液和骨髓样本显示出NGS-MRD的良好一致性,但在少数配对样本中发现不一致:在126对配对样本中,14对不一致(7对为PB中MRD阳性/ BM中MRD阴性,7对为PB中MRD阴性/BM中MRD阳性)其他研究表明,使用骨髓进行的NGS-MRD检测比使用血液的灵敏度高约1-2倍。即便如此,血液的NGS-MRD评估至少与骨髓的MFC一样敏感(如果不是更高的话),是一种以患者为中心的MRD监测方法,可减少骨髓穿刺次数。部分专家用外周血代替骨髓穿刺作为HCT后NGS-MRD监测的来源,特别是在HCT后的第一年,尽管常规使用血液应该通过前瞻性研究进一步评估。外周血NGS-MRD监测与标准骨髓检测的成本分析研究有助于确定该策略的成本效益,并支持最佳监测频率。
特别关注的亚组的NGS-MRD:Ph+ ALL和T-ALL
Ph+ ALL:国际共识分类(ICC)最近更新了BCR::ABL1 Ph+ B-ALL的定义,纳入两种亚型:BCR::ABL1+ B-ALL- l(类似于B-ALL)和BCR::ABL1+ B-ALL-M(更类似于淋巴细胞急变期的慢性髓性白血病)。目前已有多项研究表明,NGS-MRD和定量PCR在Ph+ B-ALL患者中检测BCR::ABL1存在不一致。在NGS检测不到MRD的情况下,通过PCR持续检测BCR::ABL1提示为BCR::ABL1+ B-ALL-M亚型,且与不良预后无关。相比之下,无论BCR::ABL1 PCR结果如何,NGS-MRD都能预测Ph+ B-ALL的预后(表1)。了解这一区别对于HCT前后的决策至关重要,因为当患者持续呈BCR::ABL1 PCR阳性时,临床医生可能会进行干预。作者建议在考虑干预之前,在HCT前/后用NGS或基于PCR的TCR/IgH MRD检测来确认BCR::ABL1 PCR阳性结果。
没有IgH序列的T-ALL和B-ALL:ClonoSEQ可用于无IgH、Igκ或Igλ序列的T-ALL和B-ALL,作为CLIA验证的实验室开发的测试服务,但尚未获得FDA的批准用于该适应症。对于这些适应症,检测TCRβ和TCRγ基因座的优势序列。目前还没有提供TCR优势序列的LOD。考虑到TCR序列可能不那么特有(特别是TCRγ),在MRD报告中解读低水平可检测TCR克隆序列时需谨慎。一项包括T-ALL患者(n=14)的NGS-MRD研究表明,当HCT后检测到一个以上的TCRβ和TCRγ序列位点时,复发预测的敏感性更高。监测HCT前后还需要更多基于TCRβ和TCRγ的NGS-MRD的研究,以更好地了解其预测能力。
总结
BCR和TCR基因座的二代测序可发现深度MRD,对ALL患者的管理产生了重大影响。在异基因HCT的背景下,NGS-MRD在HCT前后可提供可操作的预后信息,可用于指导临床决策。目前正在进行大量的研究,以确定从这项技术中获益最多的患者,并阐明其在各种情况下的最佳使用。虽然本文关注的是HCT背景下的NGS-MRD,但在接受非HCT治疗的ALL患者中,早期出现NGS-MRD也很重要。儿科的共识定义已经降低了定义复发的门槛,即通过多种方式检测疾病为1%,但疾病水平极低的患者(10-5 -10-7)是否应该早期治疗,以及是否可以通过使用新疗法来避免更密集的治疗(如HCT),也是未来研究的关键主题。类似的共识定义尚未应用于成人ALL;一旦患者符合移植资格的定义,本文中提出的建议就适用。
与所有新技术一样,临床医生坚定地理解其结果也很重要,这也需要熟悉度。对于解释clonoSEQ结果的额外帮助,强烈建议与具有该领域专业知识的HCT提供人员或Adaptive 公司的人员联系。认识到NGS-MRD的一个关键局限性也很重要;也就是说,它未提供关于白血病免疫表型的信息,因此可能无法为选择免疫靶向治疗提供指导。此外还需要进一步研究以确定其在检测和监测髓外病变方面的作用。最后,NGS -MRD目前在美国以外的世界范围内并不普遍可用和/或负担得起,应努力扩大获得这种变革性技术的机会。
参考文献
Muffly L,et al.How I Use Next Generation Sequencing-MRD to Plan Approach and Prevent Relapse after HCT for Children and Adults with ALL.Blood . 2024 May 10:blood.2023023699. doi: 10.1182/blood.2023023699.


