临床研究|PBC合并MAFLD的临床特征及危险因素分析
时间:2024-09-23 15:00:39 热度:37.1℃ 作者:网络
原发性胆汁性胆管炎(PBC)是一种进展性的由自身免疫介导的慢性胆汁淤积性疾病,主要靶器官为肝脏小胆管,主要发生在中老年女性。高脂血症是PBC患者的常见并发症,常以胆固醇、甘油三酯和高密度脂蛋白升高为主。代谢相关脂肪性肝病(MAFLD)作为多系统代谢紊乱累积肝脏的表现,是一种与代谢功能障碍相关的肝脏疾病,更容易与糖耐量减低、高血压、高脂血症、肥胖等多重危险因素相互关联、相互影响而加重各个因素,最后大大增加了发展为全身多系统疾病的风险。
随着医学技术的进步、检验手段的提高及人群膳食结构、生活习惯的改变,PBC合并MAFLD的检出率及患病率逐年上升。在21世纪初,由于医疗条件的限制,我国对自身免疫性肝病普遍认识不足、重视程度不够。现如今,PBC不再是罕见肝病,且随着普通人群中MAFLD的患病率持续上升,PBC合并MAFLD病例也相继被报道,然而对疾病的机制还缺乏相关研究。PBC合并MAFLD的患者起病隐匿,许多患者初诊时就已经有肝纤维化改变或者肝硬化改变,临床特征往往无特异性。由于PBC合并MAFLD的发病机制尚不明确,且临床特征存在很大的个体差异,两种疾病同时存在时对肝脏的相互作用仍存在争议,临床上对PBC合并MAFLD的诊治流程也尚未统一确定。因此,本文将对PBC合并MAFLD患者的临床特征进行回顾性分析,并对PBC合并MAFLD的危险因素进行探讨。
1资料与方法
1.1 研究对象
收集2019年1月—2022年12月就诊于昆明医科大学第一附属医院的PBC和MAFLD患者的临床资料,分为MAFLD组、PBC合并MAFLD组与PBC组。
纳入标准:PBC诊断符合《原发性胆汁性胆管炎的诊断和治疗指南(2021)》标准;MAFLD诊断符合2020年亚太肝病学会制定的《代谢相关脂肪性肝病的诊断和管理》标准。
排除标准:(1)排除PBC-AIH、PBC-PSC、PBC-AIH-PSC、病毒性肝炎、其他嗜肝病毒感染、血管性肝病、药物性肝损伤、寄生虫肝病、结核感染、HIV感染、恶性肿瘤、血液系统疾病、长期大量饮酒史等;(2)临床资料缺失影响数据统计。
1.2 研究方法
收集并分析患者的一般资料、临床症状、血清生化学指标、血清免疫学、瞬时弹性纤维成像(FibroScan)及非侵入性纤维化指标、影像学检查结果。
2结果
2.1 一般资料
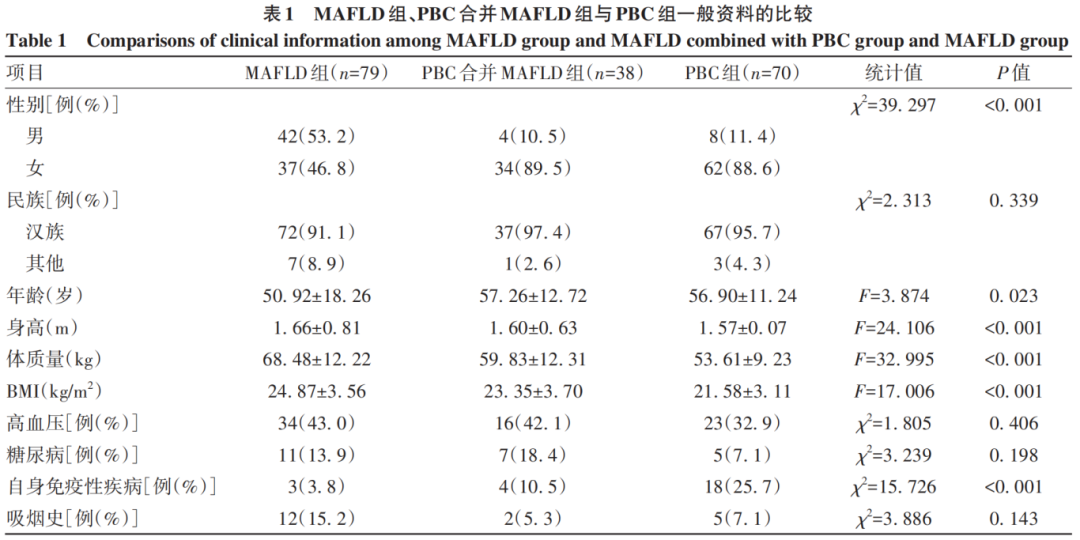
共纳入患者187例,MAFLD组79例、PBC合并MAFLD组38例,PBC组70例。三组在性别、年龄、身高、体质量、BMI、自身免疫性疾病病史方面差异均有统计学意义(P值均<0.05)(表1)。
2.2 临床表现
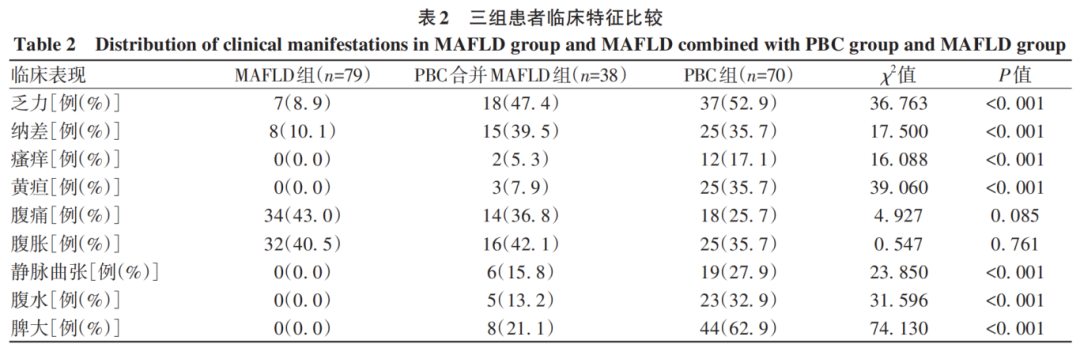
三组患者乏力、纳差、瘙痒、黄疸、静脉曲张、腹水、脾大发生率比较,差异均有统计学意义(P值均<0.05)。PBC组的症状更为严重,常见的症状及并发症为乏力、纳差、黄疸、腹痛、腹胀、静脉曲张、腹水、脾大;PBC合并MAFLD组患者常见的症状为乏力、纳差、腹痛、腹胀;MAFLD组患者常见的症状为腹痛、腹胀(表2)。
2.3 血清学及体液免疫指标
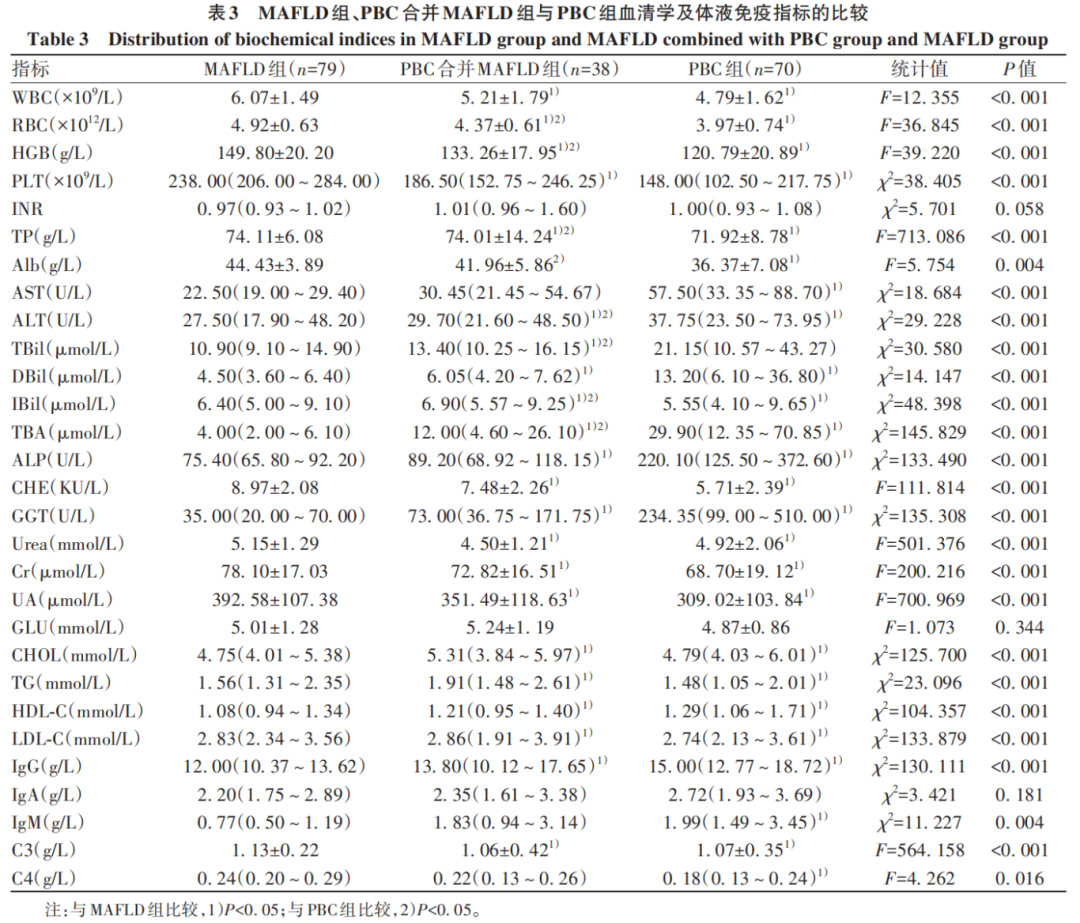
三组患者血常规指标(WBC、RBC、HGB、PLT)、肝功能指标(TP、Alb、AST、ALT、TBil、DBil、IBil、TBA、ALP、CHE、GGT)、肾功能指标(Urea、Cr、UA)、血脂指标(CHOL、TG、HDL-C、LDL-C)、免疫球蛋白及补体(IgG、IgM、C3、C4)差异均有统计学意义(P值均<0.05)(表3)。
2.4 自身免疫性肝炎抗体谱
由于MAFLD组自身免疫性抗体谱均为阴性,故比较PBC合并MAFLD组与PBC组患者的自身免疫性抗体谱各抗体的阳性率,结果显示,PBC组患者AMA-M2抗体、AMA-3E抗体阳性率明显高于PBC合并MAFLD组(P值均<0.05)(表4)。
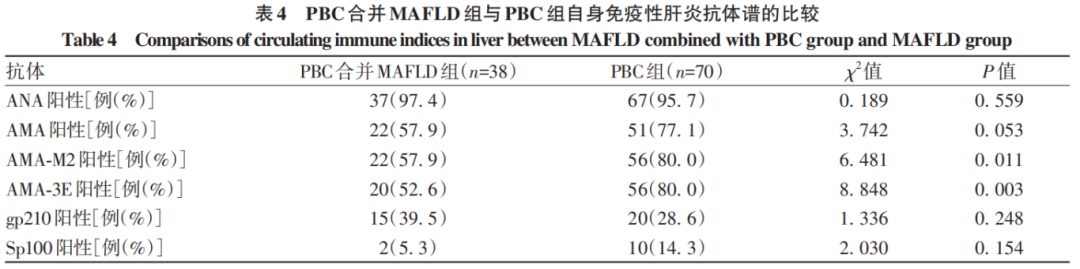
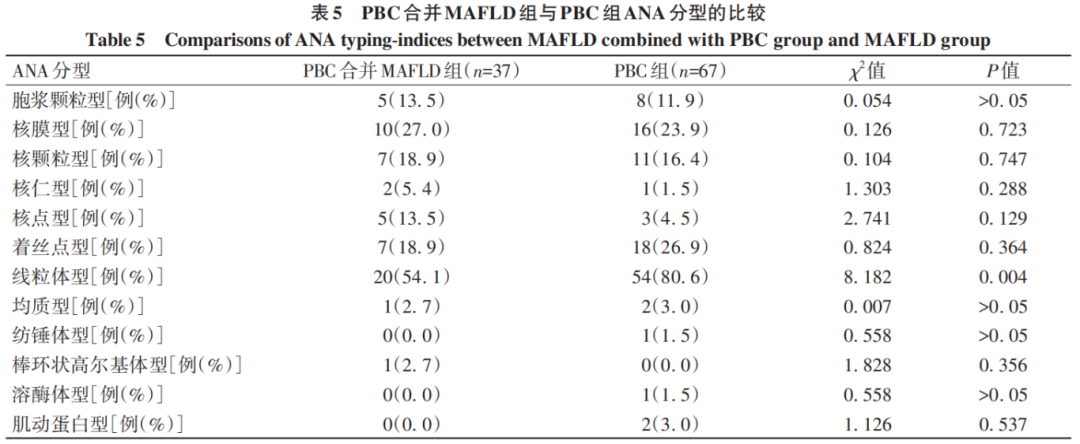
进一步比较两组在ANA分型上的差异,PBC组ANA阳性时分型为线粒体型检出率明显高于PBC合并MAFLD组(P<0.05)(表5)。
2.5 FibroScan及非侵入性纤维化指标
三组患者的CAP、LSM、APRI、FIB-4差异均有统计学意义(P值均<0.05);进一步两两比较,PBC组CAP值明显低于PBC合并MAFLD组、MAFLD组(P值均<0.05),MAFLD组LSM值明显低于PBC合并MAFLD组和PBC组(P值均<0.05)(表6)。

2.6 Logistic回归分析
将不存在多重共线性的因素(APRI、ALT、TBil、IBil、TBA、FIB-4、自身免疫性疾病史)纳入回归分析。以PBC组为参照组,FIB-4[B=-1.563,OR(95%CI):0.218(0.069~0.633)]、自身免疫性疾病史[B=-1.407,OR(95%CI):0.229(0.067~0.810)]为PBC合并MAFLD的独立影响因素(P值均<0.05);以MAFLD组为参照组,ALT[B=-1.840,OR(95%CI):0.157(0.025~1.000)]、TBil[B=-0.005,OR(95%CI):0.995(0.990~0.999)]为PBC合并MAFLD的独立影响因素(P值均<0.05)。
3讨论
从FibroScan及非侵入性肝纤维化指标来看,PBC合并MAFLD组的APRI、FIB-4值均低于PBC组;且Logistic多因素回归分析提示FIB-4评分与PBC合并MAFLD呈负相关。这与国外的一项研究结果相一致,并发非酒精性脂肪性肝病(NAFLD)的PBC患者的活动性和严重性疾病比单发PBC的患者少。这可能与PBC患者肝脏的免疫抑制调节性T淋巴细胞(Treg)的缺乏有关,在MAFLD机体中肝脏Treg的募集数量增加,免疫力得以恢复,PBC合并肝脂肪性改变时使Treg趋于平衡。
从体液免疫来看,PBC合并MAFLD组和PBC组的IgG均低于MAFLD组。本研究中PBC患者针对脂质过氧化产物的循环IgG显著增高,预先存在的脂肪性肝病可以通过增强肝脏自身抗原特异性与非特异性淋巴细胞的细胞浸润以及增强肝星状细胞活化和纤维化来增强自身免疫性肝病。相关研究发现,肝脏免疫功能的紊乱是因为肝脂肪沉积带来的脂毒性造成CD4 T淋巴细胞生成减少。异常增高的血脂水平是否会加速肝脂肪变性进一步加重PBC的进展仍存在争议。已有学者报道,PBC与NAFLD在病理组织学特征上有共存的情况,即PBC患者存在脂肪变性改变。Híndi等通过研究49例AMA阳性的PBC患者发现,其中合并肝脂肪性改变和超重的患者分别占57%和49%,研究同时发现NALFD活动性评分≥5分的PBC患者更容易发生中重度胆管损坏、合并进展期肝纤维化。另一项研究证实,氧化应激、肝脂肪变性、肥胖和饮酒是PBC的独立风险因素,40.5%和14.9%的AMA阳性PBC患者分别合并有肝脂肪变性和脂肪性肝炎,脂肪变性和脂肪性肝炎的频率与PBC恶化之间存在显著关联。在肥胖群体中,大量促炎因子和促纤维化因子由脂肪组织产生,产生的促炎因子和促纤维化因子使胆管上皮细胞受损、发生脂性凋亡,进而使PBC进展发生肝纤维化。既往研究表明,脂肪性肝炎和BMI>25 kg/m2与PBC患者严重的胆管损伤和肝纤维化有关,说明脂肪变性和BMI与门静脉炎症及胆管损伤相关。
从本研究的血脂水平观察发现,相较于MAFLD患者,PBC合并MAFLD患者的CHOL、TG、LDL-C水平较高,同时,PBC合并MAFLD组患者及PBC组患者HDL-C水平均高于MAFLD组。一项研究发现PBC患者中的HDL水平可高于NAFLD患者和正常人群,高水平的HDL可通过增加血浆载脂蛋白的浓度,进而抑制巨噬细胞转化成泡沫细胞,PBC患者载脂蛋白水平的升高被认为是抑制了肝脏的糖异生作用,防止脂肪在肝脏中堆积,具有抗炎作用,改善胰岛素敏感性,减少胰岛素抵抗,从而降低了肝脂肪变性的发生率。Reshetnyak证实,CAP值不受胆红素及转氨酶的影响,而受ALP及胆汁酸水平的影响,PBC患者对胆汁淤积的代偿表现胆固醇的升高,这种代偿反应可以中和过量的胆汁酸,进而使CAP值降低,PBC合并NAFLD患者的CAP值是否较单纯NAFLD患者低,仍需进一步研究。研究表明,PBC患者血脂异常可不伴有肝脂肪变性程度增加。这可能是因为PBC患者中表达增强的成纤维细胞生长因子19可通过诱导线粒体乙酰辅酶A羧化酶-2促进游离脂肪酸氧化来抑制肝细胞中胰岛素相关的脂肪酸合成,降低肝脂肪积累和TG水平。PBC患者肠道菌群失调和胆汁酸循环障碍可引起脂肪泻,从而影响PBC患者的脂肪吸收。PBC患者脂蛋白的升高、脂肪泻、成纤维细胞生长因子19的表达增强均会导致肝脂肪堆积降低。但这是否能说明PBC合并MAFLD时肝脂肪变性水平较低,还需要进一步论证。
从临床症状、肝功能指标、体液免疫指标、FibroScan、非侵入性肝纤维化评分及血脂情况综合分析认为,单纯PBC患者胆汁淤积程度及肝纤维化更加严重,两种疾病合并时不一定会加重PBC的疾病进展。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240815



